Page 193 - 精细化工2019年第8期
P. 193
第 8 期 孙 琳,等: Mn 3 O 4 @SiO 2 核壳磁性复合材料对钼(Ⅵ)的吸附性能 ·1681·
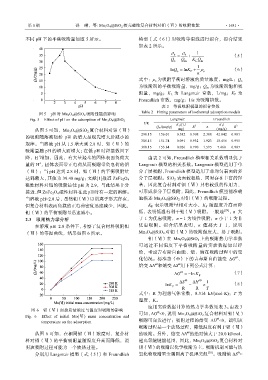
不同 pH 下的平衡吸附量如图 5 所示。 模型〔式(6)〕对吸附等温线进行拟合,拟合结果
如表 2 所示。
e e 1 (5)
Q Q K Q
e m L m
InQ InK 1 (6)
F
e
n e
式中:ρ e 为吸附平衡时溶液的质量浓度,mg/L;Q e
为吸附剂的平衡吸附量,mg/g;Q m 为吸附剂饱和吸
附量,mg/g;K L 为 Langmuir 常数,L/mg;K F 为
Freundlich 常数,mg/g;1/n 为吸附指数。
表 2 等温吸附模型的拟合参数
图 5 pH 对 Mn 3 O 4 @SiO 2 吸附性能的影响 Table 2 Fitting parameters of isothermal adsorption models
Langmuir Freundlich
Fig. 5 Effect of pH on the adsorption of Mn 3 O 4 @SiO 2
T/K Q m/(mg/g) K L/(L/ R 2 n K F/ R 2
从图 5 可知,Mn 3 O 4 @SiO 2 复合材料对钼(Ⅵ) mg) (mg/g)
298.15 156.01 0.382 0.908 2.308 42.842 0.981
的吸附随溶液初始 pH 的增大呈现先增大后减小的
308.15 151.74 0.091 0.932 1.923 18.456 0.995
规律。当溶液 pH 从 1.5 增大到 2.8 时,钼(Ⅵ)的
318.15 153.84 0.026 0.790 1.595 7.460 0.987
吸附量随 pH 的增大而增大;在低 pH 时羟基数目下
+
降,H 增加,因此,有大量羟基的固体表面负荷大 由表 2 可知,Freundlich 模型相关系数明显优于
+
量的 H ,固体表面带正电荷从而吸附带负电荷的钼 Langmuir 模型的相关系数。Langmuir 模型适用于单
(Ⅵ);当 pH 达到 2.8 时,钼(Ⅵ)的平衡吸附量 分子层吸附,Freundlich 模型适用于非均匀表面的多
分子层吸附。SiO 2 表面较粗糙,同时存在丰富的羟
达到最大,其值为 39.40 mg/g;文献[1]报道 ZnFe 2 O 4
磁性材料对钼的吸附最佳 pH 为 2.9,与此结果十分 基,因此复合材料对钼(Ⅵ)具有较强的作用力,
接近,但 ZnFe 2 O 4 磁性材料在此 pH 时有一定的溶解。 可形成多分子层吸附,因此,Freundlich 模型能准确
当溶液 pH>2.8 后,虽然钼(Ⅵ)以阴离子形式存在, 地描述 Mn 3 O 4 @SiO 2 对钼(Ⅵ)的吸附过程。
但复合材料表面负载的正电荷密度迅速减少,因此, K F 表示吸附量相对大小,K F 随温度升高而降
钼(Ⅵ)的平衡吸附量迅速减小。 低,表明低温有利于钼(Ⅵ)吸附。一般地 [29] ,n 大
2.3 吸附热力学分析 于 1 为优惠吸附,n=1 为线性吸附;n 小于 1 为非
在溶液 pH=2.8 条件下,考察了复合材料吸附钼 优惠吸附。拟合结果表明,n 值都大于 1,说明
(Ⅵ)的等温曲线,结果如图 6 所示。 Mn 3 O 4 @SiO 2 对钼(Ⅵ)的吸附强度大,易于吸附。
钼(Ⅵ)在 Mn 3 O 4 @SiO 2 上的吸附热力学参数
可通过不同温度下平衡吸附量的实验数据加以评
价,考虑吉布斯自由能、焓、熵在吸附过程中的变
化情况。标准态()下的吉布斯自由能变 ΔG 、
焓变 ΔH 和熵变 ΔS 用下列公式计算:
G ln K (7)
F
S H 1
InK (8)
R F R T
式中:R 为理想气体常数,8.314 kJ/(mol·K);T 为
温度,K。
应用实验数据计算的热力学参数见表 3。由表 3
图 6 钼(Ⅵ)初始质量浓度与温度对吸附的影响
可知,ΔG <0,说明 Mn 3 O 4 @SiO 2 复合材料对钼(Ⅵ)
Fig. 6 Effect of initial Mo(Ⅵ) mass concentration and
temperature on the adsorption 吸附可自发进行;吸附过程的焓变 ΔH <0,说明该
吸附过程是一个放热过程,降低温度有利于钼(Ⅵ)
从图 6 可知,在相同钼(Ⅵ)浓度时,复合材 的吸附。另外,焓变 ΔH 的绝对值大于 20.0 kJ/mol,
料对钼(Ⅵ)的平衡吸附量随温度升高而降低,说 超出氢键键能范围,因此,Mn 3O 4@SiO 2 复合材料对
明该吸附过程可能为一个放热过程。 钼(Ⅵ)的吸附以化学吸附为主,吸附机制可能与铁
分别用 Langmuir 模型〔式(5)〕和 Freundlich 氧化物吸附重金属阴离子机理类似 [30] 。吸附熵 ΔS >