Page 124 - 《精细化工》2020年第11期
P. 124
·2270· 精细化工 FINE CHEMICALS 第 37 卷
–1
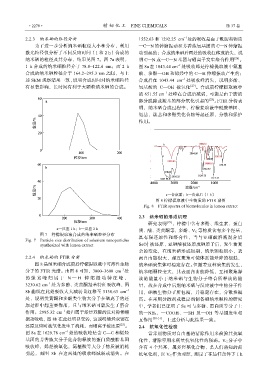
2.2.3 纳米硒的粒径分析 1552.63 和 1292.25 cm 处的吸收是由于酰胺类物质
为了进一步分析纳米硒粒径大小和分布,利用 —C—N 的伸缩振动和芳香族氨基团的 C—N 伸缩振
激光粒径仪分析了不同反应时间(1 和 2 h)合成的 动引起的;合成纳米硒后两处的吸收红移或消失,说
纳米硒的粒径及其分布,结果见图 7。图 7a 表明, 明 C—N 或—C—N 基团与硒离子发生络合作用 [26] 。
–1
1 h 合成的纳米硒粒径介于 78.8~122.4 nm;而 2 h 图 8a 在 1043.44 cm 处吸收峰是柠檬提取液中氨基
合成的纳米硒粒径介于 164.2~295.3 nm 之间,与上 酸、多酚—OH 和烯烃中的 C—H 伸缩振动产生的;
–1
述 SEM 观察结果一致,说明合成时间对纳米硒粒径 合成后在 1043.44 cm 处吸收峰消失,说明多酚、
有显著影响,长时间有利于大颗粒纳米硒的合成。 氨基酸的 C—OH 被氧化 [27] 。合成前柠檬提取液中
–1
的 651.55 cm 处峰在合成后减弱,可能是由于胺的
部分脱除或羧基的部分氘化引起的 [28] 。FTIR 分析表
明,纳米硒合成过程中,柠檬提取液中酰胺基团、
氨基、羰基和多酚类化合物等起还原、分散和保护
作用。
a—合成前;b—合成后(1 h)
图 8 柠檬提取液中生物质的 FTIR 谱图
Fig. 8 FTIR spectra of biomolecules in lemon extract
2.3 纳米硒的形成机理
[29]
研究表明 ,柠檬中含有多酚、维生素、蛋白
a—反应 1 h;b—反应 2 h
质、酯、类黄酮等,多酚、V C 等物质含有多个羟基,
图 7 柠檬提取液合成的纳米硒粒径分布 具有强还原性和络合性,当与亚硒酸溶液混合后
Fig. 7 Particle size distribution of selenium nanoparticles
2–
synthesized with lemon extract SeO 3 被还原,亚硒酸被还原成硒原子后,发生着复
杂的变化,在纳米硒形成初期,纳米颗粒很小,表
2.2.4 纳米硒的 FTIR 分析 面自由能很大,相互聚集可使体系能量降的很低,
图 8 是纳米硒合成前后柠檬提取液中可溶性生物 纳米硒聚集体可稳定存在。但随着这种聚集的发生,
–1
分子的 FTIR 光谱。由图 8 可知,3000~3600 cm 处 纳米硒颗粒变大,其表面自由能降低,互相聚集释
的强宽峰 归属于 N — H 伸缩振动特征 峰, 放的能量小于纳米硒与生物分子络合所释放的能
–1
3230.62 cm 处为多酚、类黄酮羟基特征吸收峰,图 量,故在合成中后期纳米硒与反应液中生物分子作
8b 曲线在此处吸收大大减弱且红移至 3130.63 cm –1 用,硒被生物分子所包覆,并稳定存在,分散性提
处,说明类黄酮和多酚类生物大分子在硒离子的还 高。在采用分散剂或稳定剂制备硒纳米颗粒的研究
原过程中起重要作用,且与纳米硒可能发生了螯合 中,学者们已证明了 Se 可与多糖、蛋白质等分子上
–1
作用;2995.32 cm 处归属于烯烃双键的反对称伸缩 的—NH 2 、—COOH、—SH 及—OH 等基团发生相
振动吸收,图 8b 在此处明显变弱,这说明烯烃双键在 互作用 [30-31] ,上述分析与此结果一致。
还原反应时被氧化发生了消耗,而硒离子被还原 [25] 。 2.4 抗氧化性检验
–1
图 8a 在 1629.78 cm 处的吸收峰是含 C==C 和烯烃 常常用物质对自由基的清除作用来检验其抗氧
基团的芳香族大分子化合物释放的蛋白质酰胺基团 化性,清除率用来衡量抗氧化性的强弱。V C 分子中
吸收峰,烯烃被氧化,氨基酸等大分子物质被消耗 含有 4 个羟基,属多羟基化合物,是人们熟知的强
引起,而图 8b 在这两处的吸收峰减弱或消失。在 抗氧化剂,以 V C 作为对照,测定了在最佳条件下 1 h