Page 194 - 《精细化工》2020年第3期
P. 194
·612· 精细化工 FINE CHEMICALS 第 37 卷
此外,从表 1 可以看出,染料Ⅱb 相较染料Ⅰb
(染料Ⅱc 相较染料Ⅰc)红移 46 nm(40 nm)。根
据 Kuhn 经典菁类染料理论 [14] ,最高已占有轨道
(HOMO)与最低未占有轨道(LUMO)的能级差
越小,最大吸收波长越向长波方向移动。在共轭体
系中,HOMO–LUMO 的能级差(ΔE)可以用式(1)
表示 [15] 。
h ( 2 1 n )
(1)
E
8ml 2
式中:h 为普朗克常数(6.62607015×10 –34 J·s);l
为共轭体系的长度,m;m 为电子的质量,kg;n 为
共轭体系中的电子数(n=1,2,3...)。
其中,参数 n 和 l 由共轭体系中碳原子数决定,
由公式(1)可知,HOMO–LUMO 能级差随着共轭
体系延长而减小。染料Ⅱb 相较染料Ⅰb (染料Ⅱc
相较染料Ⅰc)多了一个苯环,共轭体系增大,最大
吸收波长红移。
此外,中位 C—C 偶联之后的染料Ⅰc 和Ⅱc 相
较于中位 C—C 偶联之前的染料Ⅰb 和Ⅱb,最大吸
收波长分别蓝移了 28 和 34 nm。根据 GRIFFITHS
理论 [16] ,将多甲川链上碳原子依据它们相对端基 N
原子的位置,可以被标记为 α、β、γ、δ、ε 等,并
将共轭体系上的原子用*和非*标记成奇数交替体
系,*标记的是奇数原子,交替标记见图 3。
图 3 多甲川阳离子染料甲川链上碳原子奇数交替标记
Fig. 3 Alternating labeling of odd numbers of carbon atoms
on the methyl chain of a polymethyl cation dye
DEWAR 和 KNOTT 以 GRIFFITHS 的理论为
基础,制定了一些可预测染料颜色的规则 [17-18] :若
在非*碳原子上引入吸电子取代基或在*碳原子上
引入给电子取代基,染料的吸收波长会发生红移;
而在非*碳原子上引入给电子取代基或在*碳原子
上引入吸电子取代基,染料的吸收波长发生蓝移。 a—Ⅰb;b—Ⅱb;c—Ⅰc;d—Ⅱc
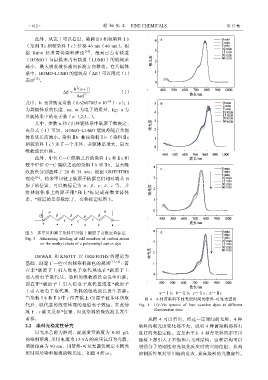
当染料Ⅰb 和Ⅱb 中 ε 位置碳上 Cl 原子被苯环所取 图 4 4 种菁染料不同光照时间的紫外-可见光谱图
代后,取代基的改变体现的是给电子效应,在此情 Fig. 4 UV-Vis spectra of four cyanine dyes at different
况下,ε 碳又是非*位置,因此染料的吸收波长发生 illumination time
蓝移。 从图 4 可以看出,经过一定时间的光照,4 种
2.2 染料光稳定性研究 染料的吸光度变化都不大,说明 4 种菁染料都具有
以无水乙醇为溶剂,配制质量浓度为 0.02 g/L 良好的光稳定性。这是由于在 4 种菁染料的多甲川
的染料溶液,采用电流为 13.4 A 的高压氙灯为光源, 链桥上都引入了不饱和六元环结构,这种结构可以
照射距离为 90 cm,用紫外-可见光谱仪测定不同光 增强分子的刚性和光氧化反应时的空间位阻,从而
照时间后染料溶液的吸光度,如图 4 所示。 抑制活性氧对甲川链的进攻,提高染料的光稳定性。