Page 47 - 《精细化工》2020年第8期
P. 47
第 8 期 曹海泳,等: 二烯酮类化合物在构建复杂有机化合物中的应用 ·1545·
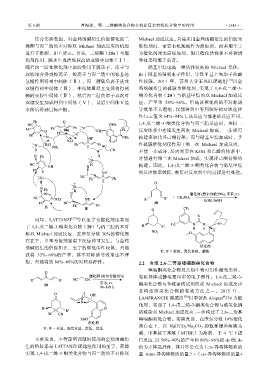
结合实验数据,对金鸡纳碱衍生伯胺催化的二 Michael 加成反应。只是采用金鸡纳碱衍生的伯胺为
烯酮与丙二腈的不对称双 Michael 加成反应的机理 催化剂时,需要有机羧酸作为添加剂,而采用奎宁
进行了推测,如下所示。首先,二烯酮(20a)与催 为催化剂时无需添加剂,但其催化活性和不对称诱
化剂作用,脱水生成活性较高的亚胺中间体(Ⅰ), 导效果稍低于前者。
随后丙二腈在催化剂中叔胺作用下脱质子,质子与 硝基甲烷也是一种活性较高的 Michael 供体,
叔胺结合得到铵离子,铵离子与丙二腈中的氰基经 由于硝基的强吸电子作用,导致甲基上氢原子的酸
氢键作用得到中间体(Ⅱ),丙二腈碳负离子进攻 性较强。2011 年,苏州大学王兴旺课题组 [10] 以金
双键得到中间体(Ⅲ),中间体Ⅲ经互变异构得到 鸡纳碱衍生的硫脲为催化剂,实现了 1,4-戊二烯-3-
新的亚胺中间体(Ⅳ),然后丙二腈负离子再次对 酮类化合物(20)与硝基甲烷的双 Michael 加成反
双键发生加成得到中间体(Ⅴ),最后中间体Ⅴ经 应,产率为 58%~86%。但是该催化剂的不对称诱
水解后得到目标产物。 导效果不太理想,仅能得到中等到较好的对映选择
性(e.e.值为 64%~94%)。该反应与前述的反应不同,
1,4-戊二烯-3-酮类化合物与丙二腈反应时,在同一
反应体系中连续发生两次 Michael 加成,一步即可
构建多取代环己酮骨架;而与硝基甲烷加成时,手
性硫脲催化剂仅作用于第一次 Michael 加成反应,
不能一步成环,反应需要在 KOH 和乙醇的体系中,
才能进行第二次 Michael 加成,实现环己酮骨架的
构建。因此,1,4-戊二烯-3-酮类化合物与硝基甲烷
的反应效率较低,需要对反应的中间过程进行处理。
同年,LATTANZI [29] 等以奎宁为催化剂也实现
了 1,4-戊二烯-3-酮类化合物(20)与丙二腈的不对
称双 Michael 加成反应,在摩尔分数 30%的催化剂
存在下,甲苯为溶剂室温下反应即可发生。与金鸡
纳碱衍生的伯胺相比,奎宁的催化活性较低,只能
获得 32%~68%的产率,其不对称诱导效果也不理
想,只能得到 80%~86%的对映选择性。 2.2 合成 2,6-二芳基噻喃酮类化合物
噻喃酮类化合物及其衍生物可用作激光染料、
有机导体或静电复印中的电子器件。1,4-戊二烯-3-
酮类化合物与含硫亲核试剂的双 Michael 加成反应
是构建该类化合物的有效方法之一。2015 年,
®
LANFRANCHI 课题组 [30] 以季铵盐 Aliquat 336 为催
化剂,实现了 1,4-戊二烯-3-酮类化合物与硫氢化钠
的硫杂双 Michael 加成反应,一步构建了 2,6-二芳基
噻喃酮类化合物。实验发现,在摩尔分数 10%催化
剂存在下,以 NaHCO 3 /Na 2 CO 3 的饱和缓冲溶液为
碱,甲基叔丁基醚(MTBE)为溶剂,于 4 ℃下进
不难发现,不管鄢明课题组使用的金鸡纳碱衍 行反应,以 50%~90%的产率和 80%~96%的 de 值〔de
生的伯胺还是 LATTANZI 课题组使用的奎宁,都能 值为立体选择性,其计算公式为(cis-异构体物质的
实现 1,4-戊二烯-3-酮类化合物与丙二腈的不对称双 量–trans-异构体物质的量)÷(cis-异构体物质的量+