Page 30 - 《精细化工》2021年第11期
P. 30
·2176· 精细化工 FINE CHEMICALS 第 38 卷
点击化学(Click chemistry)在生物医用材料领 的影响,作者通过“一锅法”制备了果胶钙凝胶纤
域中得到广泛的应用,具有产率高、副产物无害、 维,进而利用戊二醛和己二酸二酰肼实现了共价交
反应条件温和、反应速率快以及良性溶剂反应等优 联。结果表明,己二酸二酰肼交联果胶不仅提高了
势。通过点击化学,制备果胶-天然高分子杂化药物 机械强度,还能抑制其水解,但是戊二醛仅能提高
缓释载体得到较多的研究。希夫碱反应和狄尔斯-阿 其机械强度。另外,己二酸二酰肼交联果胶具备细
尔德反应(Diels-Alder reaction,DA 反应)是点击化学 胞粘附性和增殖性能。VITYAZEV 等 [46] 利用盐酸催
中常用的反应,所成键均具备动态可逆性。LI 等 [13,34] 化酯化反应,制备了甘油交联果胶钙微球。结果表
利用希夫碱反应和 DA 反应,分别制备了氧化果胶- 明,低脂果胶能够在甘油中形成凝胶,而高酯果胶
壳聚糖水凝胶和果胶-壳聚糖水凝胶。氧化果胶-壳 则不具备此性质,说明游离羧基在此过程中的重要
聚糖水凝胶和果胶-壳聚糖水凝胶的 L929 细胞增值 性。另外,甘油的加入提高了流变性和质构特性。
率(24 h,MTT 法)分别高于 80%和 90%,说明醛
基不利于细胞增殖。两类药物递送系统对 5-FU 的释 4 物理改性在果胶基药物载体中的应用
放时间均在 12 h 以上;在去离子水中,氧化果胶-
4.1 静电作用
壳聚糖/纳米氧化铁的溶胀率可达 5186%,而果胶-
如 1.2.1 部分所述,果胶可在不同 pH 条件下与
壳聚糖水凝胶的最大溶胀率为 3420%,且水凝胶的
含有—NH 2 的有机大分子或无机材料形成复合材
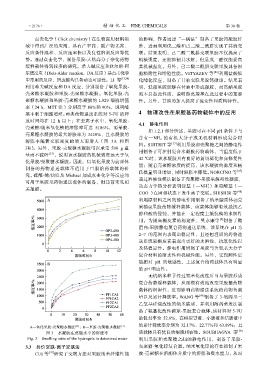
溶胀率随着交联密度的增大而增大(图 3A 和图
料。SHITRIT 等 [35] 利用果胶和壳聚糖之间的静电作
3B)。另外,果胶-壳聚糖水凝胶可以承受 500 g 重 用制备了可注射复合水凝胶药物载体,当温度低于
量而不破碎 [13] ,说明该水凝胶的机械强度远大于氧
42 ℃时,该水凝胶具有良好的剪切稀化和自修复性
化果胶/壳聚糖水凝胶。因此,以氧化果胶为前驱体
能;随着壳聚糖浓度的提高,该水凝胶的黏度和杨
制备的药物递送载体不适用于口服给药载体的研
氏模量明显增加,同时溶胀率降低。NORCINO 等 [47]
究。硫醇-烯/炔以及 Michael 加成点击化学等反应均
通过溶液注模法制备了壳聚糖-果胶基假塑性凝胶,
可用于果胶基药物递送载体的制备,但目前未见相
+
动态力学热分析表明铵基(—NH 3 )和羧酸基(—
关报道。 – [48]
COO )在固相状态下发生离子交联。SHISHIR 等
利用原材料之间的静电作用制备了纳米脂质体@壳
聚糖@果胶药物缓释载体,该载体能够有效抵抗乙
醇和酸的侵蚀,并能在一定程度上抵抗酶的水解作
[2]
用。为提高槲皮素的稳定性,樊永康等 制备了酪
蛋白-果胶静电复合药物递送系统,该系统在 pH 为
2~7 的范围内表现出稳定性,且经包埋后的药物递
送系统较槲皮素表现出更好的水溶性、抗氧化性以
及热稳定性。静电作用增强了果胶与含氨基大分子
复合材料的耐水性和机械性能。另外,受到两性官
能团对 pH 的敏感性,上述复合给药载体具有明显
的 pH 响应性。
无机纳米粒子经过氨基化改性后可与果胶形成
复合药物缓释载体,从而很有效地改变果胶基药物
载体的润湿性,进而影响药物递送系统的药物负载
量以及累计释放率。WANG 等 [49] 制备了 3-氨丙基三
乙氧基硅烷改性的纳米碳球,并利用溶剂蒸发法制
备了氨基化改性碳球-果胶复合载体。该材料对 5-FU
的包封率为 52.6%,在模拟胃液、小肠液和结肠液中
A—氧化果胶-壳聚糖水凝胶 [34] ;B—果胶-壳聚糖水凝胶 [13] 的累计释放率分别为 32.17%、22.77%和 63.89%;且
图 3 水凝胶在蒸馏水中的溶胀率 该载体具有优良的细胞相容性。SOUBHAGYA 等 [50]
Fig. 3 Swelling ratio of the hydrogels in deionized water 利用果胶和壳聚糖之间的静电作用,制备了果胶-
3.3 共价交联-离子交联法 壳聚糖-氧化锌复合膜。纳米氧化锌的存在抑制了果
CUI 等 [41] 研究了交联方法对果胶纳米纤维性能 胶-壳聚糖在溶酶体介质中的溶胀和吸水能力,从而