Page 104 - 《精细化工》2021年第6期
P. 104
·1166· 精细化工 FINE CHEMICALS 第 38 卷
–1
质素分子中紫丁香核相关联的峰(1113、1320 cm )
的减弱说明木质素分子也发生部分降解。
HBB 作用下样品红外光谱吸收峰的变化显示
HBB 显著的 BCF 结构破坏能力,如氢键、β-1,4 糖
苷键和 LCC 等化学键和官能团的破坏、木质纤维素
抗性和难降解结构的分解、碳水化合物和木质素的
分离和降解、更多纤维素、半纤维素及糖的利用,
这些都有利于 BCF 的转化过程。
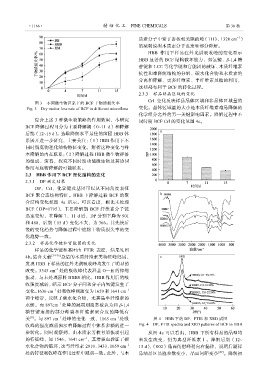
2.3.3 样品结晶区域的变化
CrI 变化反映样品晶体区域和非晶体区域量的
图 3 不同微生物区系下的 BCF 干物质损失率
Fig. 3 Dry matter loss rate of BCF in different microflora 变化。晶体区域量的大小是木质纤维素难易降解的
化学组分之外的另一关键影响因素。降解过程中不
综合上述 3 种微生物策略的作用效果,本研究 同时期 BCF CrI 的变化见图 4c。
BCF 降解过程可分为主要降解期(0~11 d)和降解
后期(12~15 d)。选取降解水平最佳的菌团 HBB 体
系展开进一步研究,主要关注:(1)HBB 作用下不
同时期底物理化结构特征变化,解析这种变化与样
本降解的内在联系;(2)降解过程 HBB 微生物群落
的组成、演替,探究不同时期功能微生物及其协同
作用与底物降解的可能联系。
2.3 HBB 作用下 BCF 理化结构的变化
2.3.1 DP 测定结果
DP、CrI、化学键及基团可以从不同角度表征
BCF 聚合态结构特征。HBB 下降解过程 BCF 的聚
合结构变化如图 4a 所示。可以看出,相比未处理
BCF(DP=1795),主要降解期 BCF 纤维素分子链
迅速变短,在降解 7、11 d 后,DP 分别下降为 901
和 480,后期(15 d)变化不大,为 366。其先快后
慢的变化趋势与降解过程中底物干物质损失率的变
化趋势一致。
2.3.2 样品化学键和官能团的变化
样品的化学键和基团由 FTIR 表征,结果见图
4b。结合文献 [24-26] 总结的木质纤维素类特征峰归属,
发现 HBB 下样品的红外光谱吸收峰均发生了明显的
–1
改变。3343 cm 处的吸收峰代表羟基 O—H 的伸缩
振动,与未处理原料 HBB0 相比,HBB 作用后的吸
收强度减弱,暗示 BCF 分子间和分子内氢键发生了
–1
变化。1636 cm 处吸收峰则演变为 1659 和 1641 cm –1
两个峰带,反映了碳水化合物,尤其是半纤维素的
–1
水解。而 897cm 处峰的减弱则通常被认为和 β-1,4
糖苷键连接的部分断裂和纤维素聚合度的降低有
[8]
–1
–1
关 。与 897 cm 处峰的变化一致,1165 cm 处吸 图 4 HBB 下的 DP、FTIR 和 XRD 谱图
收峰的强度减弱预示着降解过程中体系多糖的进一 Fig. 4 DP, FTIR spectra and XRD patterns of BCF in HBB
步转化。同时观察到,由木质素芳核骨架振动引起 从图 4c 可以看出,HBB 下所有样品的晶型均
–1
的特征峰,如 1546、1641 cm ,其增强也验证了碳 未发生改变,仍为典型纤维素Ⅰ。降解后期(12~
水化合物的破坏,这与纤维素 2910、3433、1059 cm –1 15 d),(002)晶面衍射峰稍向右偏移,说明后期样
处的特征吸收峰在作用过程中减弱一致。此外,与木 品结晶区晶胞参数变小,晶面间距变小 [27] 。降解初