Page 81 - 《精细化工》2021年第9期
P. 81
第 9 期 曾湘楚,等: 希夫碱改性 Fe 3 O 4 杂化材料的制备与表征 ·1795·
2+
2+
而增加,pH=6 时达到最大值。吸附剂吸附 Hg 的 由图 7 可知,Fe 3 O 4 @SiO 2 -S 2 对 Hg 比对其他
2+
2+
性能主要由吸附剂表面吸附位点所决定,也就是表 重金属离子具有更好的吸附性,分别比 Pb 、Cu 、
2+
3+
2+
2+
面的活性官能团(—NH 2 和—N==C—),在水溶液 Co 、Ni 、Mn 、Al 高 1.90、2.30、3.29、3.07、
+
+
2+
2+
2+
2+
中,吸附过程可以理解为 Lewis 酸(Hg 、H 3 O ) 5.67 和 5.39 倍。同样,Cd 、Pt 、Hg 、Ag 等也
对 Lewis 碱(—NH 2 或—N==CH—)的竞争过程。 属于软酸,含希夫碱基团的吸附剂对它们也有良好
+
2+
2+
2+
2+
2+
当在低 pH 时,水溶液存在的 H 3 O 远远超过 Hg 的 的吸附性能 [18-19] 。但是,Pb 、Cu 、Co 、Ni 、
+
3+
2+
数量,吸附剂表面活性位点大部分被 H 3 O 所覆盖而 Mn 、Al 却属于交界酸或硬酸与 N==C 的亲和力
+
+
2+
质子化变成—NH 3 或—CH==NH —,导致吸附剂的 不如 Hg 。
吸附量受限制。当在高 pH 时,水溶液存在的 H 3 O + 2.8 吸附剂的再生性
–
大大降低,OH 增多,吸附剂的活性位点(—NH 2 按 1.6 节方法,考察磁性杂化材料 Fe 3 O 4 @SiO 2 -
2+
或—N==CH—)去质子化,吸附剂表面开始带负电 S 2 对 Hg 的吸附再生性能,结果如图 8 所示。
2+
荷,从而有助于 Hg 的吸附。当 pH 高于 6 后,溶
2+
–
液中大量 OH 会导致 Hg 的沉淀。综上所述,最佳
pH 为 6,既能达到最佳吸附效果又不产生 Hg(OH) 2
沉淀物。
图 8 吸附剂的再生性
Fig. 8 Regeneration property of the adsorbent
由图 8 可知,第 1 次循环后吸附剂的解吸率为
图 6 pH 对 Fe 3 O 4 @SiO 2 -NH 2 和 Fe 3 O 4 @SiO 2 -S 2 吸附性能 99.03%,第 3 次循环后解吸率为 96.48%,解吸率随
的影响 着循环次数增加而呈现降低的趋势;经过 5 次吸附-
Fig. 6 Effect of pH on adsorption property of Fe 3 O 4 @SiO 2 - 解吸,吸附剂的解吸率仍保持在 89%以上,表明制
NH 2 and Fe 3 O 4 @SiO 2 -S 2
备的磁性纳米吸附材料具有良好的循环再利用性。
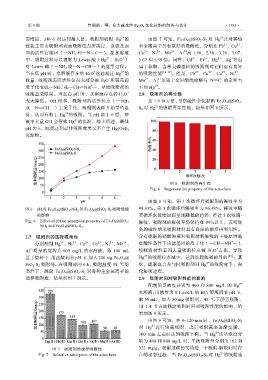
2.7 吸附剂的选择吸附性 含有硫脲的硝酸溶液对吸附材料解吸的主要原因是
+
2+
2+
2+
2+
2+
2+
分别配制 Hg 、Pb 、Cu 、Co 、Ni 、Mn 、 在酸性条件下功能基团的质子化(—CH==NH —),
+
3+
Al 质量浓度均为 800 mg/L 的水溶液,取 100 mL 使吸附材料表面大量吸附位点被 H 3 O 占据,导致
2+
置于烧杯中,用盐酸调节 pH=6,加入 200 mg Fe 3 O 4 @ Hg 的吸附位点减少,达到洗脱解吸的目的 [22] ;其
2+
SiO 2 -S 2 吸附剂,在吸附时间 6 h,吸附温度 30 ℃的 次,硫脲也会参与同吸附剂对 Hg 的吸附竞争,强
条件下,测定 Fe 3 O 4 @SiO 2 -S 2 对各种重金属离子的 化解吸过程。
选择吸附性,结果如图 7 所示。 2.9 吸附时间对吸附性能的影响
配制质量浓度分别为 400 和 800 mg/L 的 Hg 2+
水溶液,用浓度为 0.1 mol/L 的 HCl 溶液调节 pH=6,
取 50 mL,加入 50 mg 吸附剂,45 ℃下静置吸附,
用 1.4 节方法测定吸附时间对吸附性能的影响,结
果如图 9 所示。
由图 9 可知,在 0~120 min 时,Fe 3 O 4 @SiO 2 -S 2
2+
对 Hg 进行快速吸附,之后吸附速率逐渐变缓,
2+
300 min 左右时达到吸附平衡。当 Hg 质量浓度分
别为 400 和 800 mg/L 时,平衡吸附量分别为 162 和
图 7 吸附剂的选择吸附性 322 mg/g。吸附过程的实质是一个吸附-解吸同时存
2+
Fig. 7 Selective adsorption of the adsorbent 在的动态过程,当 Fe 3 O 4 @SiO 2 -S 2 对 Hg 的吸附速