Page 188 - 《精细化工》2022年第9期
P. 188
·1906· 精细化工 FINE CHEMICALS 第 39 卷
可以看出,酪蛋白酸钠-燕麦 β-葡聚糖美拉德产 集。乳化性是衡量蛋白质促进油-水型乳状液形成能
物的荧光强度较酪蛋白酸钠、酪蛋白酸钠-燕麦 β- 力的指标,乳化稳定性是指维持乳状液稳定存在的
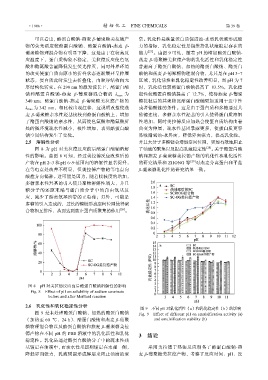
葡聚糖物理混合物有明显下降,这是由于在较高反 能力 [27] 。由图 9 可见,随着 pH 的增加酪蛋白酸钠-
应温度下,蛋白质构象不稳定,美拉德反应使色氨 燕麦 β-葡聚糖美拉德产物的乳化活性和乳化稳定性
酸和酪氨酸含量降低发生荧光猝灭,同时外界环境 普遍高于酪蛋白酸钠、加热的酪蛋白酸钠、酪蛋白
的改变使蛋白质由原本的折叠状态逐渐展开呈伸展 酸钠和燕麦 β-葡聚糖物理混合物,尤其是在 pH 3~7
状态,蛋白质此时发生去折叠化,由顺序结构向无 区域,乳化活性和乳化稳定性改善明显,当 pH 为 7
序结构化转变。在 290 nm 的激发波长下,酪蛋白酸 时,乳化活性较酪蛋白酸钠提高了 83.5%,乳化稳
钠和酪蛋白酸钠-燕麦 β-葡聚糖混合物的 λ max 为 定性较酪蛋白酸钠提高了 12.7%,使得燕麦 β-葡聚
340 nm;酪蛋白酸钠-燕麦 β-葡聚糖美拉德产物的 糖接枝后的共聚物比酪蛋白酸钠更加适用于近中性
λ max 为 342 nm,相比较出现红移,这说明改性使燕 或者偏酸性的条件。这是由于蛋白质和多糖通过共
麦 β-葡聚糖亲水性羟基接枝到酪蛋白酸钠上,增加 价键连接,多糖亲水性羟基的引入使得蛋白质溶解
了酪蛋白酸钠的亲水性,从而使色氨酸和酪氨酸所 性增加,同时美拉德反应加热会使蛋白质结构由卷
处的微环境疏水性减小,极性增加,表明酪蛋白酸 曲变为伸展,疏水性基团暴露更多,使蛋白质更容
钠空间结构发生了变化。 易吸附到油-水界面,降低界面张力,提高乳化性。
2.5 溶解性分析 并且大分子多糖链会增加空间位阻,更加有效地阻止
图 8 为 pH 对美拉德反应前后酪蛋白酸钠溶解 了油滴的聚集以及提高乳液稳定性 [28] 。关于酪蛋白酸
性的影响。由图 8 可知,经过美拉德反应改性后的 钠和燕麦 β-葡聚糖美拉德产物的乳化性和乳化活性
产物在 pH 2~3 和 pH 6~9 范围内的溶解性显著提升, 的研究结果和 ZHONG 等 [29] 对燕麦分离蛋白和平菇
在等电点处改善不明显,但美拉德产物的等电点向 β-葡聚糖乳化性的研究结果一致。
酸性方向偏移。这可能是因为,随着接枝度的增加,
多糖亲水性羟基的引入使共聚物溶解性增大,并且
糖分子的还原末端与蛋白质分子中的自由氨基反
应,减少了游离氨基所带的正电荷;另外,可能是
多糖的引入造成的,过长的糖链形成空间位阻使得聚
合物相互排斥,从而达到防止蛋白质聚集的作用 [26] 。
图 8 pH 对美拉德反应前后酪蛋白酸钠溶解性的影响
Fig. 8 Effect of pH on solubility of sodium coseinate
before and after Maillard reaction
2.6 乳化性和乳化稳定性分析
图 9 不同 pH 对乳化活性(a)和乳化稳定性(b)的影响
图 9 是未处理酪蛋白酸钠、加热的酪蛋白酸钠 Fig. 9 Effect of different pH on emulsification activity (a)
(加热至 60 ℃,24 h)、酪蛋白酸钠和燕麦 β-葡聚 and emulsification stability (b)
糖物理混合物以及酪蛋白酸钠和燕麦 β-葡聚糖美拉
德产物在不同 pH 的 PBS 溶液中的乳化活性和乳化 3 结论
稳定性。乳化是通过酪蛋白酸钠分子中的疏水性残
基锚定在油滴中,而亲水性基团则锚定在水相一侧, 采用美拉德干热法反应制备了酪蛋白酸钠-燕
降低界面张力,乳液周围形成厚层来阻止油滴的聚 麦 β-葡聚糖美拉德产物,考察了反应时间、pH、反