Page 78 - 《精细化工》2023年第11期
P. 78
·2390· 精细化工 FINE CHEMICALS 第 40 卷
结合 SDS-PAGE 实验说明,冷冻 24 h 再研磨 5 min 互作用力产生了一定的影响,但并未严重破坏胶原
对样品三螺旋结构的影响可以降到最低。 蛋白分子的三螺旋结构,其仍具有体外组装能力。
2.4 组装纤维 AFM 分析 因此,组装纤维的粒径并无显著性差异。结合
胶原蛋白具有独特的自组装成纤维的性质。为 SDS-PAGE 和 CD 分析,预冻 24 h 再研磨 5 min 对
研究冷冻研磨对胶原蛋白自组装成纤维的影响,采 胶原蛋白的天然三螺旋结构的影响最小,几乎可以
用 AFM 分析胶原蛋白组装纤维的形貌,结果见图 4。 忽略。
由图 4 可见,对照样品 COL 和 FCOL 中可观察到清
晰的胶原蛋白纤维,且每根胶原蛋白纤维出现了明暗
相间条纹(Ⅰ型胶原蛋白所特有结构:D 周期) [31] ,
进一步说明单纯冷冻预处理对胶原蛋白体外自组装
能力无影响。样品 COL3h、COL6h、COL12h 和
COL24h 无法观察到 D 周期,但是胶原蛋白的组装
纤维很明显,表明天然牛跟腱胶原蛋白冷冻研磨 上角标字母 a 是显著性差异标识,字母相同代表无显著性差异
5 min 后都保持了胶原蛋白的完整三螺旋结构。无法 图 5 牛跟腱胶原蛋白样品纤维形貌及对应纤维粒分布
观察到明显的 D 周期可能是因为胶原蛋白经冷冻研 Fig. 5 Morphology and corresponding fiber particle distribution
of bovine achilles tendon collagen samples
磨处理后的组装纤维直径较天然胶原蛋白小,猜测
是因为冷冻研磨改变了胶原蛋白大分子间相互作用 2.6 溶解度
的氢键数量 [32] ,从而使胶原蛋白纤维组装粒径变小, 天然牛跟腱胶原蛋白呈一种干燥多孔的海绵状
但并不影响胶原蛋白组装成纤维,也不影响天然胶 态,经过冷冻研磨处理后成为粉末状。为了进一步
原蛋白的自组装能力。 研究冷冻研磨对胶原蛋白水溶性的影响,采用称重
法测试研磨胶原蛋白样品在水中的溶解度,结果见
图 6。
图 4 研磨牛跟腱胶原蛋白样品的 AFM 图 图中不同字母代表有显著性差异,相同字母代表无显著性差异
Fig. 4 AFM images of ground achilles tendon collagen samples
图 6 研磨牛跟腱胶原蛋白样品的溶解度
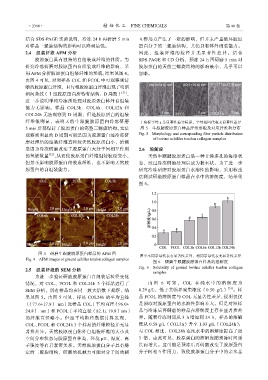
2.5 组装纤维的 SEM 分析 Fig. 6 Solubility of ground bovine achilles tendon collagen
samples
为进一步验证研磨胶原蛋白自组装后粒径变化
情况,对 COL、FCOL 和 COL24h 3 个样品进行了 由图 6 可知 , COL 在纯水中的 溶解度为
SEM 分析,所有样品均在同一放大倍数下观察,结 0.29 g/L,低于其临界聚集浓度(0.50 g/L) [33] 。样
果见图 5。由图 5 可见,样品 COL24h 的平均直径 品 FCOL 的溶解度与 COL 无显著性差异,说明仅仅
〔(77.6±17.9) nm〕比样品 COL〔平均直径(96.0± 是预冻对胶原蛋白的水溶性影响不大。但是对照样
24.8) nm〕和 FCOL〔平均直径(82.1± 19.8)nm〕 品与冷冻后再研磨的样品在溶解度上存在显著性差
的纤维直径略小。但经平均粒径数据计算发现, 异。随着冷冻时间从 3 h 增加到 24 h,样品的溶解
COL、FCOL 和 COL24h 3 个样品的纤维粒径并无显 度从 0.58 g/L(COL3h)升至 1.03 g/L(COL24h);
著性差异。天然胶原蛋白体外自组装纤维的大小及 与 COL 相比,COL24h 在纯水中的溶解度提高了近
空间分布状态与胶原蛋白种类、环境 pH、温度、离 3 倍,由此可见,胶原蛋白的溶解度随预冻时间延
子强度等有着紧密关系。天然胶原蛋白分子具有稳 长而增大。这可能是预冻后再研磨改变了胶原蛋白
定的三螺旋结构,研磨的机械力可能对分子间的相 分子间相互作用力,致使胶原蛋白分子中的亲水基