Page 79 - 《精细化工》2023年第11期
P. 79
第 11 期 刘佳林,等: 冷冻研磨对胶原蛋白分子结构及性能的调控 ·2391·
团(如—COOH、—OH)更多暴露出来,使分子亲 2.8 黏度分析
水性增加。对于 COL24h,溶解度虽然超过了临界 牛跟腱胶原蛋白样品的表观黏度与剪切速率关
聚集浓度,但原纤维生成能力减弱,COL24h 在 37 系见图 8。由图 8 可知,所有样品均表现出胶原蛋
℃下仍能组装,只是纤维粒径略变小(参见 2.5 节 白溶液典型的“剪切变稀”现象。胶原蛋白分子中
组装纤维的 SEM 分析)。尽管如此,改善胶原蛋白 的三股螺旋结构之间的作用力主要依赖于氢键等非
的水溶性仍然具有重要的作用,例如更方便取用和 共价键,所有胶原蛋白样品随着剪切速率增大,表
更好的加工性能。当用于化妆品、保健品和功能性 观黏度都表现出急剧下降的趋势。图 8 中 COL 与
添加剂时,COL24h 甚至可以少量直接添加,从而 FCOL 表观黏度随着剪切速率增加而减小,在剪切
–1
避免了酸溶解和随后透析制备胶原蛋白溶液的繁琐 速率小于 200 s 时表观黏度下降迅速,大于 200 s –1
操作 [19-20] 。 之后下降趋势趋于平缓,二者的变化趋势基本一致。
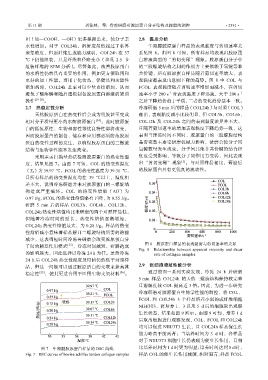
2.7 热稳定性分析 冷冻研磨 5 min 后的样品(COL24h)与对照(COL)
天然胶原蛋白在热变性后会成为明胶甚至变成 相比,表观黏度减小比较明显,但 COL3h、COL6h、
相对分子质量更小的水解胶原蛋白 [34] 。此时胶原蛋 COL12h 及 COL24h 之间的表观黏度差异并不大,
白的低抗原性、生物相容性等优良特性都将改变, 且随着剪切速率的增加表观黏度下降趋势一致,这
因而胶原蛋白的制备、储存和应用都必须防范胶原 表明当预冻时间不同时,胶原蛋白的三股螺旋结构
蛋白热变性过程的发生,以确保胶原蛋白的三螺旋 是否完整主要受研磨机械力影响,研磨会使分子间
结构与生物学性能不发生改变。 氢键数量发生改变,分子间其他非共价键的结合程
采用差示扫描量热法检测胶原蛋白的热变性温 度也受到影响,导致分子间作用力变弱,因此表现
[1]
度,结果见图 7。由图 7 可知,COL 的热变性温度 出“剪切变稀”现象 。与对照样品相比,研磨后
(T d)为 39.97 ℃,FCOL 的热变性温度为 39.31 ℃, 的胶原蛋白具有更优良的流动性。
且所有样品的热变性温度均在 39 ℃以上,温度相
差不大,说明冷冻研磨并未对胶原蛋白的三螺旋结
构造成严重破坏。COL 的热变性焓值(∆H)为
0.97 J/g,FCOL 的热变性焓值略有下降,为 0.55 J/g。
研磨 5 min 后的样品 COL3h、COL6h、COL12h、
COL24h 热变性焓值均比未研磨的两个对照样品低,
但随着冷冻时间的延长,热变性焓值逐渐增加,
COL24h 热变性焓值最大,为 0.28 J/g。样品的热变
性焓值减小意味着样品解开三螺旋结构所需的热能
减少,这表明短时间冷冻再研磨会改变胶原蛋白分
子间的相互作用模式 [35] ,冷冻时间越短,研磨造成 图 8 胶原蛋白样品的表观黏度与剪切速率的关系
Fig. 8 Relationship between apparent viscosity and shear
的影响越大,因此选择以冷冻 24 h 为佳。虽然冷冻 rate of collagen samples
24 h 后 COL24h 热变性温度及焓值仍然低于对照样
品,但这一问题可以通过胶原蛋白的交联来提高其 2.9 促细胞增殖性能分析
稳定性 [22] ,使其更适合用于医用生物支架材料 [36] 。 通过前面一系列实验发现,冷冻 24 h 后研磨
5 min 样品 COL24h 的天然三螺旋结构保持较完整
且溶解度较 COL 提高近 3 倍。因此,为进一步研究
冷冻研磨对胶原蛋白生物学性能的调控,将 COL、
FCOL 和 COL24h 3 个样品培养小鼠的成纤维细胞
NIH/3T3,将培养 1、3 以及 5 d 后的细胞取出观察
生长状态,结果如图 9 所示。由图 9 可知,培养 1 d
后取出细胞进行观察发现,COL、FCOL 和 COL24h
均可以促进 NIH/3T3 生长,且 COL24h 样品促生长
能力略高于前两者;当培养时间为 3 d 时,各样品
对于 NIH/3T3 细胞生长仍表现为促生长作用,且相
图 7 牛跟腱胶原蛋白样品的 DSC 曲线 比培养时间为 1 d 时更为明显;培养时间达到 5 d 时,
Fig. 7 DSC curves of bovine achilles tendon collagen samples 样品 COL 的促生长作用减缓,相对而言,样品 FCOL