Page 134 - 《精细化工》2023年第5期
P. 134
·1054· 精细化工 FINE CHEMICALS 第 40 卷
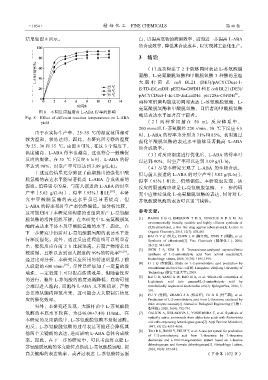
结果如图 8 所示。 白,以提高底物的跨膜效率,进而进一步提高 L-ABA
的合成效率,降低其合成成本,以实现其工业化生产。
3 结论
(1)成功构建了 2 个能够同时表达 L-苏氨酸脱
氨酶、L-亮氨酸脱氢酶和甲酸脱氢酶 3 种酶的重组
大肠杆菌 E. coli BL21 (DE3)/pACYCDuet-1-
EcTD-EsLeuDH: pET28a-CbFDH 和 E. coli BL21 (DE3)/
M
pACYCDuet-1-EcTD-EsLeuDH: pET28a-CbFDH 。
两种重组菌均能成功同时表达 L-苏氨酸脱氨酶、L-
亮氨酸脱氢酶和甲酸脱氢酶,且后者的甲酸脱氢酶
图 8 不同反应温度对 L-ABA 得率的影响
Fig. 8 Effect of different reaction temperatures on L-ABA 酶活表达水平显著高于前者。
yield ( 2 ) 两种重 组菌 在 50 mL 反应体 系中 ,
200 mmol/L L-苏氨酸经 220 r/min、30 ℃下反应 6 h
由于在实际生产中,25~35 ℃的温度范围相对
时,L-ABA 的得率为分别为 71%和 85%,表明通过
较为温和,较易达到,因此,本研究所考察的温度
强化甲酸脱氢酶的表达水平能够显著提高 L-ABA
为 25、30 和 35 ℃。由图 8 可见,在这 3 个温度下,
的合成效率。
温度越高,L-ABA 得率也越高,这也符合一般酶促 (3)对反应温度进行优化后,L-ABA 的得率可
反应的规律。在 35 ℃下反应 6 h 时,L-ABA 的得 以达到 90%,时空产率可以达到 3.09 g/(Lh)。
率达到 90%,时空产率可以达到 3.09 g/(Lh)。 (4)尽管本研究实现了 L-ABA 的生物合成,
上述这些结果充分验证了前期提出的强化甲酸 但与前人报道的 L-ABA 的时空产率〔5.02 g/(Lh)〕、
脱氢酶的表达水平能显著提高 L-ABA 合成效率的 得率(95%)相比,仍然偏低。本研究也发现,该
假设。值得思考的是,与前人报道的 L-ABA 的时空 反应的限速酶应该是 L-亮氨酸脱氢酶,下一步的研
产率〔5.02 g/(Lh)〕、得率(95%)相比 [18] ,本研 究中应继续强化 L-亮氨酸脱氢酶的表达,同时对 L-
究中甲酸脱氢酶的表达水平虽已显著提高,但 苏氨酸脱氨酶的表达可以适当减弱。
L-ABA 的得率和时空产率仍然偏低。经分析比较,
这可能归因于本研究所构建的重组菌所产 L-亮氨酸 参考文献:
脱氢酶的活性仍然不够,在本研究中 L-亮氨酸脱氢 [1] RAONI S B G, EMERSON T D S, VINICIUS N D S M. An
environmentally friendly, scalable and highly efficient synthesis of
酶的表达水平还不及甲酸脱氢酶的水平,因此,在 (S,S)-ethambutol, a first line drug against tuberculosis[J]. Letters in
下一步研究中仍需对 L-亮氨酸脱氢酶的表达水平进 Organic Chemistry, 2015, 12(7): 478-481.
[2] BAI G Y (白国义), CHEN L G (陈立功), XING P (邢鹏), et al.
行深度强化。此外,通过反应进程曲线可以明显看 Synthesis of ethambutol[J]. Fine Chemicals (精细化工), 2004,
出,催化反应在前 2 h 比较迅速,后期产物增长比 21(12): 943-945.
较缓慢,且难以达到前人报道的 99%的转化率 [6,19] 。 [3] SHIN J S, KIM B G. Transaminase-catalyzed asymmol/letric
synthesis of L-2-aminobutyric acid from achiral reactants[J].
经过比对分析,本研究反应所用的转速明显低于前 Biotechlogy Letters, 2009, 31(10): 1595-1599.
人设定的 600 r/min [19] ,尽管已经添加了一定量的玻 [4] LI J Q (李建强). Study on L-2-aminobutyric acid production by
recombinant Escherichia coli[D]. Hangzhou: Zhejiang University of
璃珠,一定程度上可以提高传质效果,但随着反应 Technology (浙江工业大学), 2019.
[5] KE C R, YANG X W, RAO H X, et al. Whole-cell conversion of
的进行,胞外 L-苏氨酸的浓度逐渐降低,底物可能 L-glutamic acid into gammol/L-2-aminobutyric acid by
会难以进入胞内,而胞外 L-ABA 又不断积累,产物 metabolically engineered Escherichia coli[J]. SpringerPlus, 2016, 5:
591.
会更难从胞内释放出来,这可能会大大限制后续反
[6] FU Y (付妍), ZHANG J X (张君轩), FU X R (付雪蓉), et al.
应的催化效率。 Production of L-2-aminobutyric acid from L-threonine catalyzed by
three enzyme cascade[J]. Journal of Biological Engineering (生物工
另外,本研究还发现,大肠杆菌中 L-苏氨酸脱
程学报), 2020, 36(4): 782-791.
氨酶的本底水平较高,为(246.00±7.40) IU/mL,在 [7] GALKIN A, KULAKOVA L, YOSHIMURA T, et al. Synthesis of
optically active aminoacids from alpha-keto acids with Escherichia
本研究的反应路线中,L-苏氨酸脱氨酶不是限速酶。
coli cells expressing heterologous genes[J]. Appl Environ Microbiol,
相反,L-苏氨酸脱氨酶的过量表达可能还会降低其 1997, 63(12): 4651-4656.
[8] TAO R S, JIANG Y, ZHU F Y, et al. A one-pot system for production
他两个关键酶的表达,进而影响 L-ABA 总体合成效
of L-2-aminobutyric acid from L-threonine by L-threonine
率。因此,在下一步的研究中,可以考虑将克隆 L- deaminase and a NADH-regeneration system based on L-leucine
dehydrogenase and formate dehydrogenase[J]. Biotechlogy Letters,
苏氨酸脱氨酶的多克隆位点换成 L-亮氨酸脱氢酶,提
2014, 36(4): 835-841.
高关键酶的表达效率,或者过表达 L-苏氨酸转运蛋 (下转第 1072 页)