Page 145 - 201901
P. 145
第 1 期 韩 旭,等: 纳米 TiO 2 增强阴离子导电膜中碱性离子液体稳定性 ·131·
子水,95 ℃下搅拌 2 h 使 PVA 完全溶解。向其中加 2 结果与讨论
入 Nano-TiO 2 (占膜总质量的 1%),室温下超声振
荡 5 h 使 Nano-TiO 2 分散均匀。然后,加入占膜总质 2.1 [DMPy][OH]离子液体结构表征
1
量不同比例的[DMPy]OH 离子液体(以 PT-5 为例, [DMPy][OH]的 HNMR 见图 1。由图 1 可知,
需添加[DMPy]OH 0.106 g,Nano-TiO 2 0.021g),磁 δ=2.3 处的峰为吡咯环上 C 3 位对称氢的吸收峰,
+
力搅拌 1 h 后,滴加 1.2 mL 质量分数为 2%的 GA δ=3.5 处的峰为 N 上两个甲基对称氢的吸收峰,
水溶液,超声振荡 0.5 h 得铸膜液,将其流延于玻璃 δ=3.8 处的峰为吡咯环 C 2 位对称氢的吸收峰,三者
板上,室温下干燥 72 h,得到系列 PVA-[DMPy][OH]- 峰面积积分比约为 1.0︰1.5︰1.0。峰的归属和积分
TiO 2 复合膜,取出待用,记为 PT-X(X=0、5、10、 面积比与目标产物中氢的归属和个数一致,证明离
–
15、20、25,下同),在 PT-X 中,[DMPy]OH 质量 子液体已被合成。另外,OH 中的氢属于活泼氢,
分数分别为 0、5%、10%、15%、20%、25%。另外, 极易被氘代而消失,因此未在图中显示;δ=0 处为
TMS 内标物的氢;δ=7.3 处为氘代氯仿的氢。
以上述制膜方法制备未掺杂 Nano-TiO 2 的复合膜,
记为 P-X(取值同上)。PT-X 复合膜结构如下所示。
图 1 [DMPy][OH]离子液体核磁共振氢谱图
1
Fig. 1 HNMR spectrum of the synthesized [DMPy][OH]
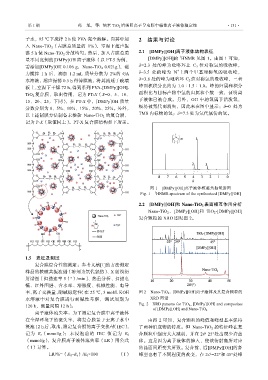
2.2 [DMPy][OH]和 Nano-TiO 2 表面相互作用分析
Nano-TiO 2 、[DMPy][OH]和 TiO 2 -[DMPy][OH]
复合颗粒的 XRD 图见图 2。
1.5 表征及测试
复合膜综合性能测定:参考文献[1]的方法测定
样品的核磁共振波谱(溶剂为氘代氯仿)、X 射线衍
射谱图〔扫描速率 5()/min〕、热重分析、扫描电
镜、红外图谱、含水率、溶胀度、机械性能、电导
率、离子交换量、耐碱稳定性(在 25 ℃,3 mol/L KOH 图 2 Nano-TiO 2 、[DMPy][OH]离子液体及其复合颗粒的
水溶液中对复合膜进行耐碱性考察,测试周期为 XRD 图谱
120 h,测量间隔 12 h)。 Fig. 2 XRD patterns for TiO 2 , [DMPy][OH] and composites
of [DMPy][OH] and Nano-TiO 2
离子液体流失率:为了测定复合膜中离子液体
在全湿环境下的流失率,将复合膜置于去离子水中 由图 2 可知,复合颗粒的峰值和峰型基本保持
浸泡 12 h 后,取出,测定复合膜的离子交换量(IEC), 了两种组成物的特质。但 Nano-TiO 2 的特征峰在复
合颗粒中强度大大减弱,并在 2=25°处出现少许蓝
记为 E t (mmol/g);未浸泡前的 IEC 值记为 E 0
(mmol/g),复合膜离子液体流失率(LR)用公式 移。这是因为离子液体的掺入,使该衍射角所对应
(1)计算。 的晶面间距变大所致。复合前、后[DMPy][OH]的各
LR/%=(E 0 –E t )/E 0 ×100 (1) 峰型也有了不同程度的改变,在 2 =22°和 45°处峰