Page 106 - 201903
P. 106
·452· 精细化工 FINE CHEMICALS 第 36 卷
亲和层析柱对酶进行分离纯化,SDS-PGAE 电泳分 2.3 重组酶催化产物分析
析纯化产物,获得电泳纯的重组酶,质量浓度达到 往 500 μL Tris-盐酸缓冲液(25 mmol/L,pH 9)
2.8 g/L。 中加入 10 mmol/L 底物-苯丙氨酸和适量的酶蛋
白,于 30 ℃反应 1 h 后加入 500 μL 无水甲醇终止
反应。HPLC、MS 和 NMR 检测底物和酶催化的产
物,结果如图 3 所示。底物-苯丙氨酸和-苯丙氨
酸标样的 HPLC 出峰时间(R t )分别是 16.2 min 和
14.1 min(图 3a 和 3b),底物-苯丙氨酸经酶催化
反应 1 h 后,在 14.1 min 出现一个峰(图 3b)。采用
制备柱分离纯化两个目标峰,利用 MS 和 NMR 进
一步鉴定酶反应底物和产物,MS 结果表明两个峰
+
的化合物的 m/Z([M+H] )均为 166.05(图 3c 和 3d),
NMR 结果表明,出峰时间为 16.2 min 核磁表征结果
表明是底物-苯丙氨酸(图 3c)〔 HNMR 400 MHz,
1
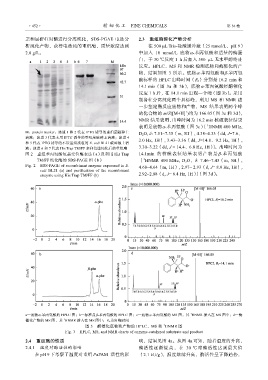
M:protein marker;泳道 1 和 2 代表 IPTG 诱导的重组菌破碎上 D 2 O, δ: 7.51~7.35(m, 5H), 4.38~4.33(dd, J=7.6、
清液;泳道 3 代表未用 IPTG 诱导的重组菌破碎上清液;泳道 4 2.0 Hz, 1H), 3.43~3.36(dd, J=14.8、9.2 Hz, 1H),
和 5 代表 IPTG 诱导的不带重组质粒的 E. coli BL21 破碎液上清
液;泳道 6 和 7 代表 His Trap TM/FF 亲和色谱纯化后的重组酶 3.30~3.22(dd, J = 14.4、6.8 Hz, 1H)〕。出峰时间为
图 2 重组苯丙氨酸氨基变位酶表达(a)及利用 His Trap 14.1min 的核磁表征结果表明产物是-苯丙氨酸
1
TM/FF 纯化酶的 SDS-PAGE 图(b) 〔 HNMR 400 MHz, D 2 O,δ: 7.46~7.43(m, 5H),
Fig. 2 SDS-PAGE of recombinant enzyme expressed in E. 4.68~4.64(m, 1H), 2.97~ 2.93(d, J= 8.0 Hz, 1H),
coli BL21 (a) and purification of the recombinant
enzyme using His Trap TM/FF (b) 2.92~2.88(d, J= 6.4 Hz, 1H)〕(图 3d)。
1
a—底物-苯丙氨酸的 HPLC 图;b—标准品-苯丙氨酸的 HPLC 图;c—底物-苯丙氨酸的 MS 图,其 HNMR 插入在 MS 图中;d—酶
1
催化产物的 MS 图,其 HNMR 插入在 MS 图中;R t 为出峰时间
1
图 3 酶催化底物和产物的 HPLC、MS 和 HNMR 图
Fig. 3 HPLC, MS, and NMR charts of enzyme-catalyzed substrate and product
2.4 重组酶的性质 响,结果见图 4a。从图 4a 可知,随着温度的升高,
2.4.1 温度对酶活性的影响 酶活性逐渐提高,在 30 ℃时酶活性达到最大值
在 pH 9 下考察了温度对重组 PaPAM 活性的影 (2.1 kU/g),温度继续升高,酶活性呈下降趋势,