Page 157 - 201906
P. 157
第 6 期 席高磊,等: 4-甲基-7-羟基香豆素及其衍生物的抗氧化性能 ·1163·
被 AAPH 氧化生成小分子羰基化合物,从另一个侧 式中:R i 为从 AAPH 分解产生的过氧自由基引发底
面亦可发现通过跟踪 TBARS 生成量很方便地监测 物氧化反应的速率,mmol/(Ls)。
DNA 氧化反应进程。当加入浓度从 100 至 400 μmol/L
的化合物Ⅱ时,TBARS 吸光度曲线与空白实验相比
有所降低,但走向与空白实验基本相同,说明化合
物Ⅱ不能影响小分子羰基化合物的生成,即化合物
Ⅱ不具有抑制 AAPH 引发的 DNA 氧化反应的活性。
当加入化合物Ⅰ后,使 TBARS 的曲线在反应开始
阶段升速变慢,表明化合物Ⅰ能够抑制 DNA 的氧化
反应,并产生一段抑制期(t inh ),说明羟基在此发挥
了抗氧化作用,这一点符合传统“酚羟基是抗氧化
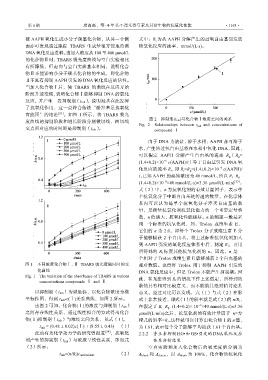
官能团”的结论 [23] 。如图 1 所示,将 TBARS 吸光
图 2 抑制期(t inh )与化合物Ⅰ浓度之间的关系
度曲线的抑制阶段和增长阶段分别做切线,两切线
Fig. 2 Relationships between t inh and concentrations of
交点所对应的时间即是抑制期(t inh )。 compound Ⅰ
由于 DNA 为钠盐,溶于水相,AAPH 亦可溶于
水,产生的过氧自由基将在水相中氧化 DNA,因此,
可以假定 AAPH 分解产生自由基的速率 R g 〔R g =
6
(1.4±0.2)×10 c(AAPH)/t〕等于自由基引发 DNA 氧
6
化反应的速率 R i ,即 R i =R g =(1.4±0.2)×10 c(AAPH)/
t,已知 AAPH 的起始浓度为 40 mmol/L,所以 R i =R g =
6
(1.4±0.2)×10 ×40 mmol/(Ls)3.36 mol/(Lmin) [25] 。
式(2)中,n 为抗氧化剂的有效计量因子,表示单
个抗氧化分子中断自由基链传递的数量,在化学体
系内可以认为是单个抗氧化分子淬灭自由基的数
量,是衡量抗氧化剂抗氧化能力的一个重要定量参
数,n 值越大,抗氧化性能越好。n 的测定一般是采
用一个标准的抗氧化剂,如:Trolox 或维生素 E,
它们的 n 为 2.0,即每个 Trolox 分子或维生素 E 分
子能够捕获 2 个自由基,将上述标准抗氧化剂加入
到 AAPH 引发的氧化反应体系中后,测定 R i ,再用
所得到的 R i 标度其他抗氧化剂的 n。因此,n 是一
个相对于 Trolox 或维生素 E 能够捕获 2 个自由基的
图 1 不同浓度化合物Ⅰ、Ⅱ TBARS 吸光度随时间的变 相对数值。也曾将 Trolox 用于抑制 AAPH 引发的
化曲线 DNA 氧化反应中,但是 Trolox 不能产生抑制期。因
Fig. 1 The variation of the absorbance of TBARS in various 此,在无法得到 R i 的情况下作上述假定,所得到的
concentrations compounds Ⅰ and Ⅱ
数值具有相对比较意义,而不能就其绝对值讨论其
以抑制期(t inh )为纵坐标,以化合物浓度为横 意义。经过对比可以发现,式(1)与式(2)在形
坐标作图,得到 t inh -c(Ⅰ)关系曲线,如图 2 所示。 式上非常接近,即式(1)的斜率就是式(2)的 n/R i ,
由图 2 可知,化合物(Ⅰ)的浓度与抑制期(t inh ) 在假定了 R i =R g =(1.4±0.2)× 10 ×40 mmol/(Ls)3.36
6
之间存在线性关系,通过线性拟合的方式得出化合 mol/(Lmin)之后,抗氧化剂的有效计量因子 n=方
物(Ⅰ)抑制期(t inh )与浓度之间关系,见式(1)。 程式的斜率×R i 。这样就可以计算出化合物Ⅰ的 n 值,
t inh = (0.48 ± 0.02)c(Ⅰ) + (8.55 ± 0.43) (1) 为 1.61,表示每个分子能够平均捕获 1.61 个自由基。
此前有关化学动力学的研究曾报道 [24] ,抗氧化 2.2.2 香豆素抑制 HO•和 GS•引发的 DNA 氧化反应
剂产生的抑制期(t inh )与浓度呈线性关系,即如式 体系分析结果
(2)所示: 空白实验和加入化合物后的吸光度值分别为
(2) A blank 和 A detect ,以 A blank 为 100%,化合物的抗氧化
t inh =(n/R i )c antioxidant