Page 164 - 201906
P. 164
·1170· 精细化工 FINE CHEMICALS 第 36 卷
由图 3 可知,在 200 ℃之前,MTX-LDH 的失 由图 5 可知,加入空白 LDHs 的浓度低于
重主要是材料表面的吸附水与层间水挥发所致 [24] ,在 200 mg/L 时,对 A549 和 MG63 细胞的活性基本没
温度升高至 600 ℃的过程中,层板上的羟基脱除, 有影响;当空白 LDHs 质量浓度达到 400 mg/L 时,
同时层间的 MTX 离子随未被置换完的硝酸根离子 仅 MG63 细胞活性出现下降,但是在药物递送体系
一起逐步分解。对比曲线 c 的 MTX 药物分解过程发 的实际应用中,LDHs 的用量不会达到如此高的浓
现,MTX 插入 LDHs 层间后,其分解初始温度由 度 [25] 。由此可知,LDHs 不会对药物插层 LDH 复合
245 ℃左右提高至超过 330 ℃,主要是因为层板表 物的效果评价产生影响,从毒性方面考虑,LDHs
面羟基的脱除迟滞了热量的传导,使层间药物的热 比较适合作为药物载体材料 [26-27] 。
稳定性得以提升。当温度超过 600 ℃后,样品质量 2.3 缓释性能
的变化基本趋于稳定,MTX-LDH 在 650 ℃时的残 MTX-LDH 在模拟不同 pH 环境下的释药曲线
留率为 48.3%,介于空白 LDHs 的 53.2%和 MTX 的 如图 6 所示。由图 6 可知,当缓冲液 pH 为 7.4 时,
38.2%之间,证明 MTX-LDH 确为 LDHs 和 MTX 的 载药复合物 2 h 的累积释放率为 41.2%,低于 Wang [28]
复合产物。 等 MTX 插层 ZnAl-LDH 复合物的 2 h 累积释放率
2.2.4 TEM 分析 (50.0%),未发生突释;2 h 后,药物释放速度缓慢;
空白 LDHs 和载药后 MTX-LDH 的 TEM 照片如
12 h 时,药物累积释放率为 55.0%。当 pH 为 5.8 时,
图 4 所示。从图 4 中观察可知,经过水热合成处理
MTX-LDH 复合物释药速度显著加快,释药 12 h 时,
后的 LDHs 具有优异的分散性和均一的纳米级粒径
其累积释放率达到 93.7%,表现出 pH 响应型释放特
分布,虽然 MTX 插层复合后,容易导致复合物颗
征,这是因为载体板层在弱酸环境中因溶蚀而产生
粒出现团聚现象,降低分散性能,但通过加入适量
持续释放。
的聚乙二醇 400 增加了颗粒间的接触阻力,提高了
反应体系的分散性,同时合理控制 MTX 加入量避
免了 LDHs 因过量负载而出现沉降现象,所以
MTX-LDH 具有良好的分散性。
图 6 不同 pH 缓冲液中 MTX-LDH 的释放曲线
图 4 LDHs(a)和 MTX-LDH(b)的 TEM 图 Fig. 6 Release profiles of MTX-LDH in different pH
Fig. 4 TEM images of LDHs(a) and MTX-LDH(b) buffer solutions
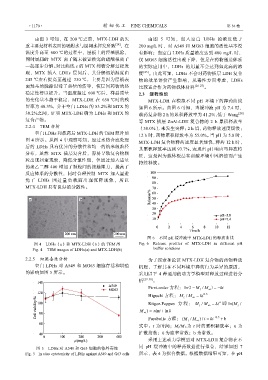
2.2.5 细胞毒性分析 为了探索和论证 MTX-LDH 复合物的药物释放
空白 LDHs 对 A549 和 MG63 细胞存活和增殖 机理,了解其在不同环境中释药行为差异的原因,
的影响如图 5 所示。 采用以下 4 种通用的动力学模型对释放过程进行分
析 [29-30] 。
First-order 方程: ln 1 M ( t / M ) kt
Higuchi 方程: M t / M kt 0.5
n
Ritger-Peppas 方程: M t / M kt 即 ln(M t /
M ) lnnt ln k
Parabolic 方程: ( t /M )M / t kt 0.5 b
式中:t 为时间;M t /M∞为 t 时的累积释放率;n 为
扩散指数;k 为速率常数;b 为常数。
采用上述动力学模型对 MTX-LDH 复合物在不
图 5 LDHs 对 A549 和 G63 细胞的体外毒性 同 pH 缓冲液中的释药数据进行拟合,结果如图 7
Fig. 5 In vitro cytotoxicity of LDHs against A549 and G63 cells 所示,表 4 为拟合数据。根据数据结果可知,在 pH