Page 66 - 201907
P. 66
·1312· 精细化工 FINE CHEMICALS 第 36 卷
Luo 等 [21] 研究表明,一定浓度的 CaCl 2 溶液能 酪氨酸和苯丙氨酸。3 种氨基酸中,色氨酸的荧光
够加强 CS-LMP 溶液的盐稳定性,但 CaCl 2 溶液浓 强度最强,对环境最为敏感,所以研究蛋白质的构
度过高,会导致复合物发生聚集。从图 3a 可以看出, 象变化时,常将其作为蛋白质的内源荧光探针。在
随着 CaCl 2 溶液浓度的升高,3 种 pH 的纳米复合物 槲皮素质量浓度为 0 时,酪蛋白的最大荧光强度在
粒径均呈现出先降低后升高的趋势,这表明一定浓 344 nm 处,此处可以理解为色氨酸的荧光强度。且
度的 CaCl 2 溶液可以减小复合物粒径,当 CaCl 2 溶液 随着槲皮素浓度的升高,酪蛋白的最大荧光强度逐
质量浓度为 20 g/L 时,纳米复合物的粒径最小,为 渐降低,并且最大荧光发射峰所对应的波长发生一
346.1 nm(p<0.05),随着 CaCl 2 溶液质量浓度继续 定程度的蓝移。槲皮素中的芳香环在疏水作用力的
升高,复合物的粒径升高,这可能是因为 CaCl 2 溶 作用下与酪蛋白中的色氨酸结合可能导致酪蛋白发
液的静电屏蔽作用降低了聚合物的电荷量,从而降 生荧光猝灭。Fang 等 [22] 研究结果表明,多酚中的芳
低了它们之间的静电斥力,这从图 3b 中 Zeta 电位 香基团能够通过疏水作用力与蛋白质中色氨酸结
合,导致其发生荧光猝灭。这些研究结果也表明了蛋
的变化也可以得到证实。从图 3c 可以看出,当 CaCl 2
浓度为 20 g/L,pH=4.0 时,复合物的 PDI 最低(<0.3), 白质可以通过其氨基酸侧链与多酚中芳香基团结合。
这表明 CS-LMP 复合物是一种均一的状态。
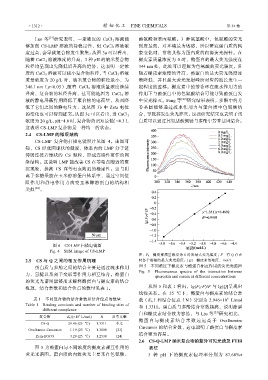
2.4 CS-LMP 的微观结构
CS-LMP 复合物扫描电镜照片见图 4。由图可
知,CS 形成圆球状的凝胶,体系内的 LMP 分子链
伸展连接着球状的 CS 颗粒,形成连续性更佳的网
络结构。这说明 LMP 能改善 CS 在等电点附近的聚
沉现象,提高 CS 在等电点附近的稳定性。这与阴
离子多糖果胶在玉米醇溶蛋白体系中,通过空间位
阻作用和静电作用力改变玉米醇溶蛋白的结构相
类似 [22] 。
图 4 CS-LMP 扫描电镜图
Fig. 4 SEM image of CS-LMP
注:F 0—槲皮素质量浓度为 0 时的最大荧光强度;F—有 Q 存在
2.5 CS 与 Q 之间的相互作用机理 时各个溶液的最大荧光强度;[Q]—槲皮素的浓度,mol/L
蛋白质与多酚之间的结合主要是通过疏水作用 图 5 不同浓度下槲皮素与酪蛋白相互作用的荧光光谱图
Fig. 5 Fluorescence spectra of the interaction between
力、氢键以及离子交联等作用力相互结合。酪蛋白 quercetin and casein at different concentrations
的荧光光谱图能够用来解释酪蛋白与槲皮素的结合
机理,结合常数和结合位点的数量见表 1。 从图 5 和表 1 看出,lg(F 0 -F)/F 与 lg[Q]呈现出
线性关系。在 25 ℃下,酪蛋白与槲皮素的结合常
表 1 不同复合物的结合常数和结合位点的数量 数(K b )和结合位点(N)分别为 2.946×10 L/mol
6
Table 1 Binding constants and number of binding sites of 和 1.3311。蛋白质与多酚结合常数越高,说明酪蛋
different complexes
白和槲皮素结合较为容易,与 Liu 等 [23] 研究相比,
5
复合物 K b/(×10 L/mol) N 参考文献
酪蛋白与槲 皮素结合常 数远远高 于 Ovalbumin-
CS-Q 29.46 (25 ℃) 1.3311 本文
Curcumin 的结合常数,这也说明了酪蛋白与槲皮素
Ovalbumin-Curcumin 1.19 (25 ℃) 1.3000 [23]
结合更为容易。
Zein-EGCG 3.29 (25 ℃) 1.2538 [24]
2.6 CS-Q-LMP 纳米复合物的紫外可见光谱及 FTIR
图 5 为酪蛋白与不同浓度的槲皮素相互作用的 表征
荧光光谱图。蛋白质的内源荧光主要来自色氨酸、 3 种 pH 下的槲皮素包埋率分别为 87.68%±