Page 157 - 《精细化工》2020年 第10期
P. 157
第 10 期 张晓攀,等: EZH2 甲基转移酶抑制剂的设计、合成及其抑制活性 ·2087·
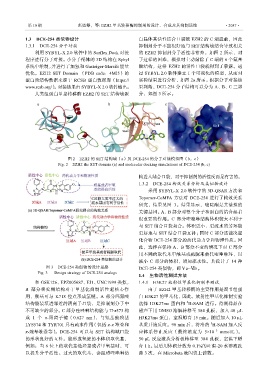
1.3 DCE-254 类似物设计 白晶体其活性结合口袋被 EZH2 的 C 端遮蔽,因此
1.3.1 DCE-254 分子对接 抑制剂分子不能很好地与 SET 结构域结合导致相关
利用 SYBYL-X 2.0 软件中的 Surflex Dock 对接 的 EZH2 抑制剂分子活性非常差。如图 2 所示,对
程序进行分子对接。小分子配体的 3D 结构在 Sybyl 于这样的困难,模拟时主动敲除了 C 端的 6 个氨基
系统中绘制,并进行了加氢和 Gasteiger-Marsili 能量 酸结构,这样 EZH2 的活性口袋就得到了暴露。通
优化。EZH2 SET Domain (PDB code:4MI5)的 过 SYBYL 2.0 软件建立 1 个可视化的模型,从而对
蛋白质结构数据来源于 RCSB 蛋白数据库(https:// 实验结果进行分析,如图 2a 所示。根据分子对接结
www.rcsb.org/)。对接结果由 SYBYL-X 2.0 软件输出。 果判断,DCE-254 分子结构可以分为 A、B、C 三部
人类组蛋白甲基转移酶 EZH2 的 SET 结构域蛋 分,如图 3 所示。
图 2 EZH2 的 SET 结构域(a)及 DCE-254 的分子对接模拟图(b,c)
Fig. 2 EZH2 the SET domain (a) and molecular docking simulations of DCE-254 (b, c)
构进入结合口袋,对于抑制剂的活性反而是有害的。
1.3.2 DCE-254 构效关系分析及类似物设计
采用 SYBYL-X 2.0 软件中的 3D-QSAR 方法和
Topomer-CoMFA 方法对 DCE-254 进行了构效关系
研究,结果见图 3。结果显示,嘧啶酮是其活性的
关键基团。A、B 部分对整个分子和蛋白的结合起着
很重要的作用。C 部分喹唑啉结构体积较大不利于
与 SET 结合口袋契合。体积更小、更疏水的芳环能
更好地与 SET 结合口袋互补;同时 C 部分还能决定
化合物 DCE-254 部分的药代动力学和物理性质。因
此,选择在保持 A、B 部分不变的情况下对 C 部分
用不同的取代苯甲酰基或硫脲来替代喹唑啉环,以
减小 C 部分的体积,增加疏水性。共设计了 14 种
图 3 DCE-254 类似物的设计思路 DCE-254 类似物,即Ⅴa~Ⅵh。
Fig. 3 Design strategy of DCE-254 analogs
1.4 生物活性测试方法
和 GSK126、EPZ005687、EI1、UNC1999 类似, 1.4.1 H3K27 放射性甲基化抑制率测试
B 部分嘧啶酮结构对于甲基化抑制活性起核心作 由于 EZH2 甲基转移酶的主要作用是调节组蛋
用,羰基可与 K718 位点形成氢键。A 部分四氮唑 白 H3K27 的甲基化,因此,放射性甲基化抑制实验
3
结构能装填进邻近的阴离子口袋,是抑制剂分子中 选择 H3K27me 蛋白和 H-SAM 进行。待测样品在
不可缺少的部分。C 部分喹唑啉结构能与 Thr573 构 超声下用 DMSO 溶解转移至 384 孔板,加入 40 μL
成 1 个 π-阳离子键(0.627 nm),与氨基酸残基 H3K27me 蛋白,室温孵育 15 min。随后加入 10 μL
3
LYS574 和 TYR701 具有疏水作用(包括 π-π 堆叠和 基质开始反应。90 min 后,将冷的 H-SAM 加入反
–5
π-烷基堆叠等)。DCE-254 可以与 SET 结构域口袋 应体系停止反应(最终浓度为 5×10 mmol/L)。
的形状良好的互补。能形成氢键的小体积取代基, 50 μL 反应液从分析板转移至 384 孔板,室温下孵
例如:当 6 位上的取代基是羟基或者甲氧基时,可 育 1 h。最后用体积分数为 0.1%的吐温-20 水溶液洗
以提升分子活性。过大的取代基,会阻碍喹唑啉结 涤 3 次,在 Microbeta 液闪仪上读数。