Page 152 - 《精细化工》2020年第12期
P. 152
·2514· 精细化工 FINE CHEMICALS 第 37 卷
0
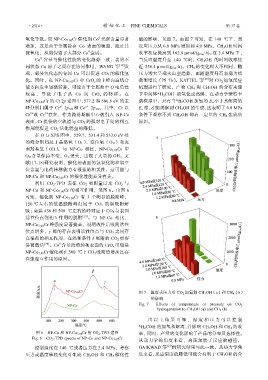
氧化导致。而 NP-Co 3.00 Cr 催化剂 Co 元素含量显著 能的影响,见图 7。由图 7 可知,在 140 ℃下,当
增加,这是由于金属盐在 Co 表面的覆盖,阻止其 反应压力从 0.8 MPa 增加到 4.0 MPa,CH 3 OH 时间
0
被氧化,从而保留了大部分 Co 金属。 收率相应提高到 162.8 µmol/(g Cat ·h)。在 2.4 MPa 下,
0
Co 含量与催化性能的变化趋势一致,表明不 当反应温度升至 140 ℃时,CH 3 OH 的时间收率接
同状态 Co 原子之间存在协同作用,WANG 等 [16] 发 近 256.4 µmol/(g Cat ·h)。CH 4 的变化则大不相同,随
现,部分氧化态的金属 Co 可以促进 CO 2 的催化氢 压力增大呈现火山型趋势,而随温度升高表现为指
化。同时,在 NP-Co 3.00 Cr 中 CrO x 的主峰向高结合 数型增长(图 7b)。KATTEL 等 [20] 对 CO 2 加氢反应
能方向发生轻微转移,可能由于金属盐中 O 电负性 机理进行了研究,产物 CH 4 和 CH 3 OH 的分布来源
较 高 , 导致了 电子 从 Co 向 CrO x 的转 移。 在 于中间体*H 2 COH 的氢化或离解,在动力学蒙特卡
NP-Co 3.00 Cr 的 Cr 2p 谱图中,577.2 和 586.8 eV 的主 洛模拟中,只有当*H 2 COH 加氢的 E a 小于其解离的
x+
峰分别归属于 Cr x+ 2p 3/2 和 Co 2p 1/2 ,其中,Cr 以 E a 时,才能观察到 CH 3 OH 的生成,这表明了 0.8 MPa
2+
3+
Cr 或 Cr 存在,作为路易斯酸中心被引入 NP-Co 条件下观察不到 CH 3 OH 却有一定量的 CH 4 生成的
表面,Cr 提供的空轨道与 CO 2 的孤对电子间的相互 原因。
作用能促进 CO 2 活化能垒的降低。
在 O 1s XPS 图中,529.7、531.4 和 533.0 eV 处
的峰分别归属于晶格氧(O L )、空位氧(O V )和表
面羟基氧(OH)。与 NP-Co 相比,NP-Co 3.00 Cr 中
O V 含量保持不变,O L 消失,出现了大量的 OH。文
献[17-18]研究表明,催化剂表面的氢氧化物和氧空
位含量与电荷转移能力有很强的相关性,这可能与
NP-Co 和 NP-Co 3.00 Cr 的催化性能差异有关。
利用 CO 2 -TPD 表征 CO 2 吸附量以及 CO 2 与
NP-Co 和 NP-Co 3.00 Cr 的相互作用,见图 6。由图 6
可知,催化剂 NP-Co 3.00 Cr 有 3 个明显的脱附峰,
150 ℃左右的低温脱附峰归属于 CO 2 的弱吸附解
吸;高温 450 和 500 ℃左右的峰对应于 CO 2 与表面
活性位点强相互作用的脱附 [19] 。与 NP-Co 相比,
NP-Co 3.00 Cr 峰强度显著提高,说明改性后吸附活性
位点增多,γ 峰的存在表明活性位点与 CO 2 之间存
在很强的相互作用,在温和条件下吸附的 CO 2 更容
0
易被激活 [20] 。Co 含量的增加和表面的 CrO x 可能是
NP-Co 3.00 Cr 催化剂在 500 ℃下 CO 2 吸附量增加且存
在强相互作用的原因。
图 7 温度或压力对 CO 2 加氢制 CH 3 OH(a)和 CH 4 (b)
的影响
Fig. 7 Effects of temperature or pressure on CO 2
hydrogenation to CH 3 OH (a) and CH 4 (b)
由以上结 果可知, 温度和压 力可以控制
*H 2 COH 的加氢和解离,并影响 CH 3 OH 和 CH 4 的收
图 6 NP-Co 和 NP-Co 3.00 Cr 的 CO 2 -TPD 谱图 率,同时,产量的变化影响了产品的分布及选择性。
Fig. 6 CO 2 -TPD spectra of NP-Co and NP-Co 3.00 Cr
从动力学的角度来看,高压加快了反应物碰撞,
控制温度在 140 ℃或者压力在 2.4 MPa,考察 GAIKWAD 等 [21] 的研究结果与此一致。从热力学角
压力或温度单独变化对生成 CH 3 OH 和 CH 4 催化性 度来看,反应温度的降低可能会有利于 CH 3 OH 的合