Page 57 - 《精细化工》2020年第4期
P. 57
第 4 期 韩金玲,等: 高吸附性能介孔磁性复合碳球的制备 ·691·
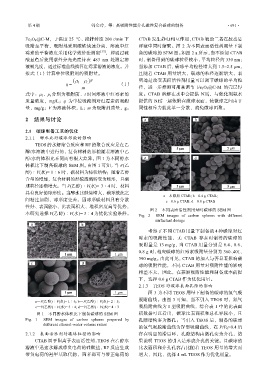
Fe 3 O 4 @C-M,于温度 25 ℃、搅拌转速 200 r/min 下 CTAB 发生静电相互作用,CTAB 辅助二者在胶态悬
吸附至平衡,吸附剂采用磁铁快速分离,溶液中红 浮液中同时缩聚。图 2 为不同表面活性剂用量下制
霉素的平衡浓度采用化学效价法测定 [13] ,即通过硫 备的碳球的 SEM 图。如图 2 a 所示,当不添加 CTAB
酸显色后使用紫外分光光度计在 483 nm 处测定溶 时,制备得到的碳球粒径较小,平均粒径约 330 nm;
液吸光度,通过标准曲线换算红霉素溶液的浓度。并 当添加 CTAB 后,碳球平均粒径增大到 1.5~2.5 m,
按式(1)计算单位吸附剂的吸附量。 且随着 CTAB 用量增大,碳球的粒径逐渐增大,表
V 明通过改变表面活性剂用量可以调节碳球的平均粒
q 0 t (1)
m 径,进一步推测可用来调节 Fe 3 O 4 @C-M 的壳层厚
+
式中:ρ 0 、ρ t 分别为吸附前、t 时间溶液中红霉素的 度。CTAB 溶解在水中会提供 NH 4 ,与催化剂氨水
+
质量浓度,mg/L;q 为单位吸附剂对红霉素的吸附 提供的 NH 4 一起依附在微球表面,使微球之间由于
量,mg/g;V 为溶液体积,L;m 为吸附剂质量,g。 同性相斥力彼此单一分散,避免微球团聚。
2 结果与讨论
2.1 碳球制备工艺的优化
2.1.1 醇水比对碳球形貌的影响
TEOS 的水解缩合反应和 RF 的聚合反应是在乙
醇/水溶液中进行的,复合材料的形貌随着溶液中乙
醇/水的体积比不同而有很大差异。图 1 为不同醇水
体积比下制备碳球的 SEM 图。由图 1 可知,当 V(乙
醇)∶V(水)= 1∶6 时,碳材料为棒状结构;随着乙醇
含量的增加,复合材料的形貌逐渐转变为球形,且碳
球粒径逐渐增大。当 V(乙醇)∶V(水)= 3∶4 时,材料
具有良好的球形度。当醇水比继续增大,碳球彼此之
a—未添加 CTAB; b—0.4 g CTAB;
间粘连加剧,球形度变差。因球形碳材料具有分散 c—0.6 g CTAB; d—0.8 g CTAB
性好、表面能小、比表面积大、堆积密度高等优势,
图 2 不同表面活性剂用量时碳球的 SEM 图
本研究选择 V(乙醇)∶V(水)= 3∶4 为优化实验条件。 Fig. 2 SEM images of carbon spheres with different
surfactant dosage
考察了不同 CTAB 用量下制备的 4 种碳球对红
霉素的吸附性能,无 CTAB 存在时制得的碳球的
吸附量是 13 mg/g,当 CTAB 用量分别是 0.4、0.6、
0.8 g 时,相应碳球的红霉素吸附量分别为 360、401、
390 mg/g。由此可见,CTAB 的加入与否显著影响碳
球的吸附性能,不同 CTAB 用量对吸附性能的影响
相差不大,因此,在兼顾吸附性能和制备成本前提
下,选择 0.6 g CTAB 作为优化用量。
2.1.3 TEOS 对碳球表面孔隙的影响
图 3 为不同 TEOS 用量下制备的碳球的氮气吸
脱附曲线。由图 3 可知,当不引入 TEOS 时,氮气
a—V(乙醇)∶V(水)= 1∶6; b—V(乙醇)∶V(水)= 2∶5;
c—V(乙醇)∶V(水)= 3∶4; d—V(乙醇)∶V(水)= 4∶3 吸脱附曲线为 I 型吸附曲线,综合表 1 中的比表面
图 1 不同醇水体积比下制备碳球的 SEM 图 积数据可以看出,碳球比表面积和总孔容较小,且
Fig. 1 SEM images of carbon spheres prepared by 孔隙结构多为微孔;当引入 TEOS 后,制备的碳球
different ethanol-water volume ratios
的氮气吸脱附曲线为Ⅳ型吸附曲线,在 P/P 0 >0.4 后
2.1.2 表面活性剂对碳球粒径的影响 存在明显的滞后环,孔隙结构由微孔变为介孔,结
CTAB 属于阳离子表面活性剂,TEOS 在乙醇水 果说明 TEOS 的引入是形成介孔的关键。且碳球的
溶液中迅速水解成带负电荷的硅酸盐,RF 反应生成 比表面积和介孔孔容占比随着 TEOS 用量的增大而
带负电荷的羟甲基取代物,两者都可与带正电荷的 增大,因此,选择 4 mL TEOS 作为优化用量。