Page 155 - 《精细化工》2021年第3期
P. 155
第 3 期 顾 娜,等: 千克级 DPP-4 抑制剂氢溴酸替格列汀工艺改进 ·575·
曲振动吸收峰,以上结果表明,氢溴酸替格列汀结 上 H 的化学位移;δ 3.70~3.61 (m,2H)为吡咯烷基上
构与预期相符。 H 的化学位移;δ 3.16~3.12 (m,2H)为—SCH 2CH 2N—
2.1.5 氢溴酸替格列汀 XRD 分析 上 H 的化学位移;δ 3.06 (dd,2H)为吡咯烷基上 H
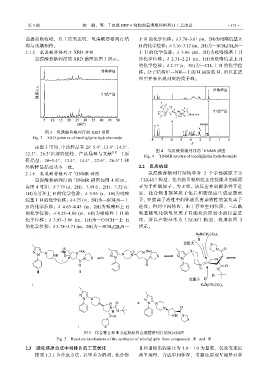
氢溴酸替格列汀的 XRD 谱图如图 3 所示。 的化学位移;δ 2.31~2.21 (m,1H)为吡咯烷基上 H
的化学位移;δ 2.17 (s,3H)为—CH 3 上 H 的化学位
移。分子结构中—NH—上的 H 属活泼 H,所以在谱
图中并未出现对应的质子峰。
图 3 氢溴酸替格列汀的 XRD 谱图
Fig. 3 XRD patterns of teneligliptin hydrobromide
由图 3 可知,中试样品在 2θ=5.4°、13.4°、14.5°、 1
22.5°、26.5°出现特征峰,产品晶型与文献 [15] (原 图 4 氢溴酸替格列汀的 HNMR 谱图
1
Fig. 4 HNMR spectra of teneligliptin hydrobromide
研晶型:2θ=5.4°、13.4°、14.4°、22.6°、26.5°)和
外购样品晶型基本一致。 2.2 反应机理
1
2.1.6 氢溴酸替格列汀 HNMR 谱图 氢溴酸替格列汀结构中含 2 个手性碳原子为
1
氢溴酸替格列汀的 HNMR 谱图如图 4 所示。 (2S,4S)构型,化合物Ⅱ吡咯烷上连接羰基的碳原
由图 4 可知,δ 7.79 (d,2H)、7.49 (t,2H)、7.32 (t, 子为手性碳原子,为 S 型。该反应在弱酸条件下进
1H)为芳环上 H 的化学位移;δ 5.96 (s,1H)为吡唑 展,化合物Ⅱ羰基质子化后和胺反应生成亚胺离
烷基上 H 的化学位移;δ 4.75 (m,2H)为—SCH 2 N—上 子,亚胺离子活性中间体被具有亲核性的氢负离子
H 的化学位移;δ 4.63~4.43 (m,2H)为哌嗪环上 H 进攻,得到中间体Ⅳ,由于存在空间位阻,三乙酰
的化学位移;δ 4.28~4.00 (m,6H)为哌嗪环上 H 的 氧基硼氢化钠氢负离子只能从位阻较小的位置进
化学位移;δ 3.93~3.86 (m,1H)为—COCH—上 H 攻,所以产物基本为(2S,4S)构型,机理如图 5
的化学位移;δ 3.78~3.71 (m,2H)为—SCH 2 CH 2 N— 所示。
图 5 化合物Ⅱ和Ⅲ为起始原料合成替格列汀的反应机理
Fig. 5 Reaction mechanism of the synthesis of teneligliptin from compounds Ⅱ and Ⅲ
2.3 胺化还原合成中间体Ⅳ的工艺优化 Ⅱ和Ⅲ物质的量比为 1.0∶1.0 为基准,仅改变还原
按照 1.3.1 节合成方法,以甲苯为溶剂,化合物 剂Ⅴ用量,合成中间体Ⅳ,考察还原剂Ⅴ用量对中