Page 223 - 《精细化工》2022年第2期
P. 223
第 2 期 柯 浩,等: 依折麦布关键中间体的合成工艺优化 ·427·
依折麦布(Ezetimibe),化学名(3R,4S)-1-(4-氟 原料,采用一锅法制备Ⅰ,在二异丙基乙胺(DIPEA)
苯基)-3(R)-[3-(4-氟苯基)-3(S)-羟基丙基]-4(S)-(4-羟 的作用下,用三甲基氯硅烷(TMSCl)对Ⅱ和Ⅲ进
[5]
基苯基)-2-氮杂环丁酮,由先灵葆雅和默克公司共同 行羟基保护,在 TiCl 4 催化下进行类 Mannich 反应 ,
开发,2002 年在德国首次上市,同年在美国上市, 经酸猝灭反应后脱去羟基保护,最后加入 N,O-双三
具有选择性抑制胆固醇吸收的作用 [1-2] ,与他汀类药 甲基甲硅烷基乙酰胺(BSA)进行羟基保护,得到
物联用可有效降低血浆中胆固醇水平 [3-4] ,是首个由 产物Ⅰ(收率 65%)。经重复性实验验证,首先发现,
食品药品监督管理局(FDA)批准上市的新型口服 以 TMSCl 为羟基保护剂的保护效率对Ⅱ显著,而对
降血脂药物。合成依折麦布的关键技术是分子结构 Ⅲ不明显,推测Ⅲ中苯环与其相连的酚羟基形成共
[5]
中四元环的构建 ,而该四元环一般是由化合物 轭,苯环上电子云密度降低,酚羟基亲核性减弱,
+
(S)-3-{(2R,5S)-5-(4- 氟苯基 )-2-((S)-[(4- 氟苯 基 ) 氨 进攻 TMSCl 中—Si (CH 3 ) 3 速率降低,而Ⅱ中醇羟基
基]{4-[(三甲基硅基)氧基]苯基}甲基)-5-[(三甲基硅基) 无共轭,其对应醇羟基亲核性比酚羟基大,从而保
氧基]戊酰基}-4-苯基唑烷-2-酮(Ⅰ)环合而成 [6-8] , 护效率 比 Ⅲ高; 其 次达不 到 文献报 道 的 收 率
因此化合物Ⅰ是合成依折麦布的关键中间体。 (35%~55%)。由于 TiCl 4 呈酸性,采用一锅法羟基保
[9]
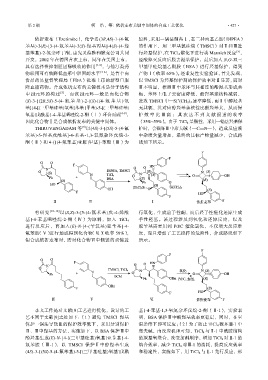
THIRUVENGADAM 等 以(4S)-3-[(5S)-5-(4-氟 护时,会破坏Ⅲ中席夫碱(—C==N—),造成反应液
苯基)-5-羟基戊酰基]-4-苯基-1,3-氧氮杂环戊烷-2- 中杂质含量增加,最终的目标产物量减少,合成路
酮(Ⅱ)和 4-{[(4-氟苯基)亚胺]甲基}-苯酚(Ⅲ)为 线如下所示。
有研究 [10-12] 以(S,Z)-3-[5-(4-氟苯基)戊-4-烯酰 行氧化,生成前手性酮,而后经手性催化还原生成
手性羟基。该过程涉及到氧化和还原反应,以及
基]-4-苯基唑烷-2-酮(Ⅳ)为原料,加入 TiCl 4
进行反应后,再加入(E)-N-[4-(苄氧基)亚苄基]-4- 脱苄基需要用到 Pd/C 催化氢化,不仅增大反应难
氟苯胺(Ⅴ)进行加成得到化合物(Ⅵ)(收率 59%), 度,而且增加了工艺操作的危险性,合成路线如下
但合成依折麦布时,需对化合物Ⅵ中侧链的双键进 所示。
本文工作是对文献[9]工艺进行优化,设计的工 基}-4-苯基-1,3-氧氮杂环戊烷-2-酮(Ⅱ-1),实验表
艺不同于文献[9]之处如下:(1)避免 TMSCl 羟基 明,BSA 保护Ⅲ中酚羟基效率更稳定,同时,在室
保护一锅法导致Ⅲ的保护效率低下,采用分别保护 温条件下即可反应;(2)为了防止 TiCl 4 破坏Ⅲ-1 中
Ⅱ、Ⅲ中羟基的方法,实施如下,以 BSA 保护Ⅲ中 席夫碱,由反应机理可知,TiCl 4 与Ⅱ-1 中酰胺结构
酚羟基生成(E)-N-{4-[(三甲基硅基)氧基]亚苄基}-4- 的羰基氧络合,改变加料顺序,增加 TiCl 4 对Ⅱ-1 的
氟苯胺(Ⅲ-1),以 TMSCl 保护Ⅱ中醇羟基生成 络合效率,减少 TiCl 4 对Ⅲ-1 的消耗,提高反应效率
(4S)-3-{(5S)-5-(4-氟苯基)-5-[(三甲基硅基)氧基]戊酰 和稳定性,实施如下,用 TiCl 4 与Ⅱ-1 先行反应,形