Page 65 - 《精细化工》2022年第5期
P. 65
第 5 期 倪金荧,等: 混合菌的构建及其对 3,4-二氯苯胺的生物转化 ·919·
对混合菌转化率的影响最大,与直观分析结果一致。 化合物 3,4-二氯乙酰苯胺(3,4-DCAA),即混合菌
群以 3,4-DCA 为原料,经乙酰化反应生成主要的代
表 2 正交实验设计及结果
Table 2 Orthogonal experimental design and results 谢产物为 3,4-DCAA。3,4-DCAA 毒性很小,植物能
够在含有 3,4-DCAA 的土 壤中 生长, 而在 含有
影响因素 3,4-DCA
序号 3,4-DCA 的土壤中无法生长 [17] 。很多文献报道乙酰
摇床转速/(r/min) 温度/℃ pH 转化率/%
化是微生物的一种有效解毒机制 [17-20] 。
1 190 28 7 65.08
2 190 30 8 89.26
3 190 32 9 79.84
4 200 28 8 83.17
5 200 30 9 77.74
6 200 32 7 65.05
7 210 28 9 70.43
8 210 30 7 63.24
9 210 32 8 82.01
K 1 78.06 72.90 64.45
K 2 75.32 76.74 84.82
K 3 71.89 75.63 76.00
R 6.17 3.84 20.37
表 3 正交实验方差分析结果
Table 3 Variance analysis of orthogonal test
因素 平方和 df 均方 F P
摇床转速 57.277 2 28.639 119.755 0.008
温度 23.595 2 11.798 49.333 0.020
pH 625.335 2 312.668 1307.443 0.001
误差 0.478 2 0.239
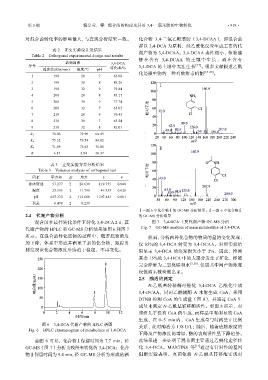
Ⅰ—图 6 中化合物Ⅰ的 GC-MS 分析结果;Ⅱ—图 6 中化合物Ⅱ
2.4 代谢产物分析 的 GC-MS 分析结果
混合菌在最佳转化条件下转化 3,4-DCA 2 d,其 图 7 3,4-DCA 主要代谢产物 GC-MS 分析
代谢产物的 HPLC 和 GC-MS 分析结果如图 6 和图 7 Fig. 7 GC-MS analysis of main metabolites of 3,4-DCA
所示。在混合菌转化底物的过程中,随着底物浓度 然而,分析两种化合物的物质的量的变化发现,
的下降,体系中形成并积累了新的化合物,跟踪监 仅 85%的 3,4-DCA 转变为 3,4-DCAA。对照实验结
测发现该化合物浓度后续趋于稳定,不再变化。 果显示 3,4-DCA 的蒸发损失小于 2%,因此,推测
其余 15%的 3,4-DCA 中的大部分发生了矿化,即被
完全降解为二氧化碳和水 [5,10] ,但因其中间产物浓度
较低而未被检测出来。
2.5 酶活的测定
N-乙酰基转移酶可催化 3,4-DCA 乙酰化生成
3,4-DCAA,同时乙酰辅酶 A 水解生成 CoA,采用
DTNB 检测 CoA 的生成量(图 8),并通过 CoA 生
成量来测定 N-乙酰基转移酶活性。如图 8 所示,对
照组几乎没有 CoA 的生成,而样品中有明显的 CoA
生成,在 0~5 min 内,CoA 生成量与时间呈正比例
图 6 3,4-DCA 代谢产物的 HPLC 谱图 关系,此时酶活为 138 U/L;随后,随着底物浓度的
Fig. 6 HPLC chromatogram of metabolites of 3,4-DCA
下降及产物浓度的增加,酶的表观活性呈下降趋势。
由图 6 可见,化合物Ⅰ保留时间为 7.7 min,经 此结果进一步证明了混合菌主要通过乙酰化途径转
GC-MS(图 7)分析为残留未转化的 3,4-DCA;化合 化 3,4-DCA。MARTINS 等 [17] 通过有针对性的基因
物Ⅱ保留时间为 9.4 min,经 GC-MS 分析为形成的新 阻断实验表明,真菌依赖 N-乙酰基转移酶实现对