Page 152 - 《精细化工》2023年第1期
P. 152
·144· 精细化工 FINE CHEMICALS 第 40 卷
①
表 2 底物的普适性 加入浓盐酸,能以 90%的产率获得盐酸高巴氯芬(图 3)。
①
Table 2 Universality of reaction substrates
编号 芳基硼酸 产物 产率/%
②
1 Ⅰa Ⅲa 98
2 Ⅰb Ⅲb 97
3 Ⅰc Ⅲc 96
4 Ⅰd Ⅲd 98
5 Ⅰe Ⅲe 97
6 Ⅰf Ⅲf 95
7 Ⅰg Ⅲg 97
8 Ⅰh Ⅲh 95
9 Ⅰi Ⅲi 95
①反应条件为Ⅱ(0.2 mmol),芳基硼酸(0.4 mmol),
[Rh(COD)Cl] 2 (0.005 mmol),KOH 水溶液(0.1 mL,1.0 mol/L),
1.0 mL 1,4-二氧六环,在 100 ℃反应 10 h;②分离产率。 图 2 中间体Ⅳ的合成路线
2.3 Ⅲb 的衍生化研究 Fig. 2 Synthesis route of intermediate Ⅳ
根据文献[23]可知,Ⅲb 在 6 mol/L 盐酸中回流 8 h
后,有望顺利脱去邻苯二甲酰亚胺保护基团,且同
时水解戊酸甲酯片段,从而直接获得盐酸高巴氯芬。
结果显示,未得到盐酸高巴氯芬,以 92%的产率获
得了含羧基的邻苯二甲酰亚胺基-3-对氯苯基戊酸
图 3 盐酸高巴氯芬的合成路线
(中间体Ⅳ,图 2)。
Fig. 3 Synthesis route of homobaclofen hydrochloride
值得一提的是,只需过滤操作,就可以高纯度、
高产率、克级获得中间体Ⅳ。获得中间体Ⅳ后,通过 2.4 反应机理的推测
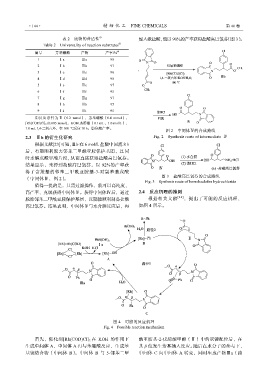
脱除邻苯二甲酰亚胺保护基团,以期能顺利制备盐酸 根据相关文献 [24] ,提出了可能的反应机理,
高巴氯芬。结果表明,中间体Ⅳ与水合肼反应后,再 如图 4 所示。
图 4 可能的反应机理
Fig. 4 Possible reaction mechanism
首先,催化剂[Rh(COD)Cl] 2 在 KOH 的作用下 酰亚胺基-2-戊烯酸甲酯(Ⅱ)中的双键配位后,在
生成中间体 A,中间体 A 再与苯硼酸反应,生成苯 其 β 位发生芳基插入反应。随后在水分子的参与下,
基铑络合物(中间体 B)。中间体 B 与 5-邻苯二甲 中间体 C 向中间体 A 转变,同时生成产物Ⅲa(路