Page 146 - 《精细化工》2023年第11期
P. 146
·2458· 精细化工 FINE CHEMICALS 第 40 卷
DB104 (pWB980)、B. subtilis MTV13 和 B. subtilis 50%(图 2b),说明突变体 ManBl(I91N/L211I)的热
FGYM102 在相同条件下进行发酵 4 d 后,对发酵液 稳定性较对照组有所降低,该结果与 I-mutant 2.0 预
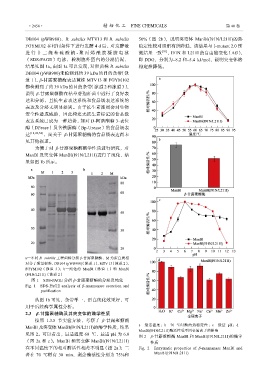
进行十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳 测结果一致 [39] ,I91N 和 L211I 的自由能变化(ΔG),
(SDS-PAGE)电泳,检测胞外蛋白的分泌情况, 即 DDG,分别为–8.2 和–5.4 kJ/mol,说明突变体热
结果见图 1a。由图 1a 可以发现,对照菌株 B. subtilis 稳定性降低。
DB104 (pWB980)未检测到约 39 kDa 的目的条带(泳
道 1),β-甘露聚糖酶表达菌株 MTV13 和 FGYM102
都检测到了约 39 kDa 的目的条带(泳道 2 和泳道 3),
说明 β-甘露聚糖酶在枯草芽孢杆菌中进行了良好表
达和分泌,且抗生素表达系统和食品级表达系统的
表达及分泌无明显差别。由于抗生素滥用会对生物
安全性造成威胁,因此构建无抗生素标记的食品级
表达系统已成为一种趋势,如对 D-阿洛酮糖 3-表位
酶(DPease)及含铁脲酶(Bp-Urease)的食品级表
达 [18,20,38] ,而关于 β-甘露聚糖酶的食品级表达尚未
见其他报道。
为便于对 β-甘露聚糖酶酶学性质进行研究,对
ManBl 及突变体 ManBl(I91N/L211I)进行了纯化,结
果如图 1b 所示。
a—不同 B. subtilis 工程菌株分泌 β-甘露聚糖酶,M 为蛋白质相
对分子质量标准,DB104 (pWB980)(泳道 1)、MTV 13(泳道 2)、
FGYM102(泳道 3);b—纯化的 ManBl(泳道 1)和 ManBl
(I91N/L211I)(泳道 2)
图 1 SDS-PAGE 分析 β-甘露聚糖酶的分泌及纯化
Fig. 1 SDS-PAGE analysis of β-mannanase secretion and
purification
从图 1b 可见,条带单一,蛋白纯化效果好,可
用于后续酶学属性分析。
2.3 β-甘露聚糖酶及其突变体的酶学性质
按照 1.3.5 节实验方法,考察了 β-甘露聚糖酶
ManBl 及突变体 ManBl(I91N/L211I)的酶学性质,结果 a—最适温度;b—70 ℃时酶的热稳定性;c—最适 pH;d—
ManBl(I91N/L211I)酶活性受不同金属离子的影响
见图 2。可以看出,最适温度 60 ℃、最适 pH 为 6.0 图 2 β-甘露聚糖酶 ManBl 和 ManBl(I91N/L211I)的酶学
(图 2a 和 c)。ManBl 和突变体 ManBl(I91N/L211I) 性质
在不同温度下的相对酶活性相差不明显(图 2a);二 Fig. 2 Enzymatic properties of β-mannanase ManBl and
者在 70 ℃孵育 30 min,剩余酶活性分别为 75%和 ManBl(I91N/L211I)