Page 148 - 《精细化工》2023年第11期
P. 148
·2460· 精细化工 FINE CHEMICALS 第 40 卷
相关性。事实上,酶的催化区域正是因为具有柔性构 由图 7 可知,ManBl及突变体 ManBl(I91N/L211I)
象,才能更好容纳底物分子,发挥催化活性。但是该 对 β-甘露聚糖酶的酶活性随发酵时间的不同而不同,
柔性的增加,在提高催化活性的同时,有可能导致热 在 1~4 d,酶活性随发酵时间延长而增加,B. subtilis
稳定性的降低。该分子动力学预测结果与实验结果一 MTV13 和 B. subtilis FGYM102 的最高酶活性分别为
致,即突变体 ManBl(I91N/L211I)催化活性较野生型 5882.3 和 17601.3 U/mL。
提高,但热稳定性降低(图 2b)。 2.6 KGM 水解产物分析
应用 Autodock 软件预测了酶与底物的对接情 应用 ManBl 或突变体 ManBl(I91N/L211I)在
况,结果见图 6。 60 ℃水解 KGM 30 min,二者形成的甘露寡糖组成及
质量分数见图 8。
由图 8a 和 b 可见,β-甘露聚糖酶突变体的催化
性质并没有发生变化。
由图 8 a 可知,当 ManBl 添加量由 0.5 U/mL 增
至 50 U/mL 时,形成的 MOS 质量分数约 80%。由图
8 b 可知,ManBl(I91N/L211I)添加量由 0.5 U/mL 增
至 50 U/mL 时,形成的 MOS 质量分数提高到 85%,
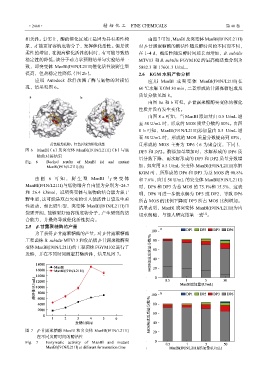
黄色棍为底物;红色区域为催化残基 且形成的 MOS 主要为 DP6(6 为聚合度,下同)、
图 6 ManBl(a)及突变体 ManBl(I91N/L211I)(b)与底 DP3 和 DP2。酶添加量增加时,水解形成的 DP6 质
物的对接结果 量分数下降,而水解形成的 DP3 和 DP2 质量分数增
Fig. 6 Docked results of ManBl (a) and mutant
ManBl(I91N/L211I) (b) 加,如应用 0.5 U/mL 突变体 ManBl(I91N/L211I)水解
KGM 时,所形成的 DP6 和 DP3 为总 MOS 的 90.8%
由图 6 可知 , 野生型 ManBl 与突变体 和 7.6%,应用 50 U/mL 的突变体 ManBl(I91N/L211I)
ManBl(I91N/L211I)与底物结合自由能为分别为–24.7 时,DP6 和 DP3 为总 MOS 的 75.1%和 15.5%,这表
和–26.4 kJ/mol,说明突变体与底物的结合能力强于 明,DP6 可进一步被水解为 DP3 或 DP2,导致 DP6
野生型,这可能是双点突变的引入使活性口袋发生柔 所占 MOS 的比例下降而 DP3 所占 MOS 比例增加。
性运动,相比野生型,突变体 ManBl(I91N/L211I)口 结果表明,ManBl 或突变体 ManBl(I91N/L211I)为内
袋更开阔,能够更好地容纳底物分子,产生更强的结 切水解酶,与前人研究结果一致 。
[1]
合能力,并最终导致催化活性提高。
2.5 β-甘露聚糖酶的产量
为了获得 β-甘露聚糖酶的产量,对 β-甘露聚糖酶
工程菌株 B. subtilis MTV13 和食品级 β-甘露聚糖酶突
变体 ManBl(I91N/L211I)的工程菌株 FGYM102 进行了
发酵,并在不同时间测定其酶活性,结果见图 7。
图 7 β-甘露聚糖酶 ManBl 和突变体 ManBl(I91N/L211I)
在不同发酵时间的酶活性
Fig. 7 Enzymatic activity of ManBl and mutant
ManBl(I91N/L211I) at different fermentation time