Page 62 - 《精细化工》2023年第11期
P. 62
·2374· 精细化工 FINE CHEMICALS 第 40 卷
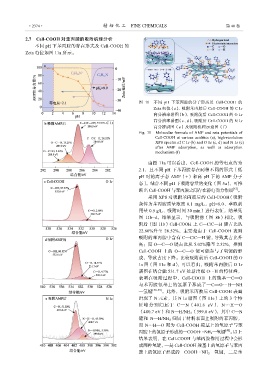
2.7 Cell-COOH 对苯丙胺的吸附机理分析
不同 pH 下苯丙胺的存在形式及 Cell-COOH 的
Zeta 电位如图 11a 所示。
图 11 不同 pH 下苯丙胺的分子形态及 Cell-COOH 的
Zeta 电位(a)、吸附苯丙胺后 Cell-COOH 的 C 1s
高分辨率谱图(b)、吸附前后 Cell-COOH 的 O 1s
高分辨率谱图(c、d)、吸附后 Cell-COOH 的 N 1s
高分辨谱图(e)及吸附机理示意图(f)
Fig. 11 Molecular formula of AMP and zeta potentials of
Cell-COOH at various acidities (a), high-resolution
XPS spectra of C 1s (b) and O 1s (c, d) and N 1s (e)
after AMP adsorption, as well as adsorption
mechanism (f)
由图 11a 可以看出,Cell-COOH 的等电点约为
2.1,且不同 pH 下苯丙胺存在两种不同的形式〔低
pH 时的离子态 AMP(+)和高 pH 下的 AMP 分子
态〕。结合不同 pH 下吸附容量的变化(图 5a),可推
断出 Cell-COOH 与苯丙胺之间存在静电引力作用 [37] 。
采用 XPS 对吸附苯丙胺后的 Cell-COOH(吸附
条件为苯丙胺质量浓度 0.1 mg/L,pH=8.0、萃取剂
用量 0.5 g/L、吸附时间 30 min)进行表征,结果见
图 11b~d。结果显示,与吸附前(图 8b)相比,吸
附后(图 11b)Cell-COOH 上 C—C/C—H 键占比从
22.60%升至 28.52%,主要是由于 Cell-COOH 表面
吸附的苯丙胺中含有 C—C/C—H 键,导致其占比升
高;而 O—C==O 键占比从 5.02%降至 2.32%,推测
Cell-COOH 上的 O—C==O 键可能参与了氢键的形
成,导致占比下降。比较吸附前后 Cell-COOH 的 O
1s 图(图 11c 和 d),可以看出,吸附苯丙胺后 O 1s
谱图在结合能 531.7 eV 处新出现 O…H 的特征峰,
表明在吸附过程中,Cell-COOH 上的羧基—C==O
与苯丙胺氨基上的氢原子形成了—C==O…H—NH
—氢键 [38-39] 。此外,吸附苯丙胺后 Cell-COOH 表面
出现了 N 元素,其 N 1s 谱图(图 11e)上的 3 个特
征峰分别归属于 C—N(401.6 eV)、N…H—O
(400.7 eV)和 N—H/NH 2 (399.8 eV),其中 C—N
键和 N—H/NH 2 归属于材料表面上吸附的苯丙胺,
而 N…H—O 则为 Cell-COOH 羧基上的氢原子与苯
丙胺上的氮原子形成的—COOH…NH 2 —氢键 [40] 。以上
结果表明,在 Cell-COOH 与苯丙胺作用过程中会形
成两种氢键,一是 Cell-COOH 羧基上的氢原子与苯丙
胺上的氮原子形成的—COOH…NH 2 —氢键,二是苯