Page 72 - 《精细化工》2023年第5期
P. 72
·992· 精细化工 FINE CHEMICALS 第 40 卷
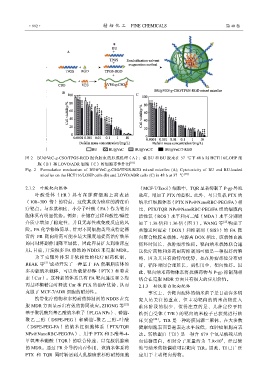
图 2 BU@VeC-g-CSO/TPGS-RGD 混合胶束的形成机理(A);载 BU 和 BU 胶束在 37 ℃下 48 h 对 HCT116/LOHP 细
胞(B)和 LOVO/ADR 细胞(C)的细胞毒性作用 [18]
Fig. 2 Formulation mechanism of BU@VeC-g-CSO/TPGS-RGD mixed micelles (A); Cytotoxicity of BU and BU-loaded
micelles on the HCT116/LOHP cells (B) and LOVO/ADR cells (C) in 48 h at 37 ℃ [18]
2.1.2 叶酸靶向配体 (MCF-7/Taxol)细胞中,TQR 显著抑制了 P-gp 外流
叶酸受体(FR)具有在肿瘤细胞上高表达 效应,增加了 PTX 的蓄积。此外,与只负载 PTX 的
(100~300 倍)的特点,这使其成为癌症的潜在治 纳米红细胞体系(PTX NPs@NanoRBC-PEG/FA)相
疗靶点。与多肽相比,小分子叶酸(FA)作为靶向 比,PTX/TQR NPs@NanoRBC-PEG/FA 组的细胞内
配体具有明显优势。例如:在储存过程和酸性/碱性 活性氧(ROS)水平和丙二醛(MDA)水平分别增
介质中增加了稳定性,并且无毒性或免疫反应的风 加了 1.38 倍和 1.36 倍(图 3)。WANG 等 [23] 构建了
险。FA 化学修饰简单,针对不同细胞类型或特定器 共输送阿霉素(DOX)和抑制剂(SIS3)的 FA 靶
官的 FR 靶向给药可能在最大限度地提高治疗效果 向聚合物胶束载体。与游离 DOX 相比,该载体血液
的同时将副作用降至最低,因此容易扩大到临床应 循环时间长,抗肿瘤活性强。靶向纳米载体联合递
用。目前,开发很多 FA 修饰的 NDDS 来克服 MDR。 送化疗药物和多药耐药抑制剂可能是一种很好的策
为了克服外排泵非依赖性的化疗耐药机制, 略,因为其具有独特的优势,如在肿瘤部位分布更
BEAK 等 [21] 成功开发了一种基于 FA 偶联脂质体的 好,循环时间合理延长,副作用少,靶向性好。因
多功能纳米载体,可以负载紫杉醇(PTX)和姜黄 此,靶向纳米药物体系将抗癌药物与 P-gp 抑制剂相
素(Cur)。这种新的体系具有 FA 靶向递送和 2-羟 结合在克服 MDR 方面具有很大的应用价值。
丙基环糊精定时释放 Cur 和 PTX 的治疗优势,从而 2.1.3 转铁蛋白靶向配体
克服了 MCF-7/ADR 细胞的耐药性。 事实上,含靶向配体的纳米粒子是目前许多研
携带化疗药物和多药耐药抑制剂的 NDDS 在克 究人员关注的重点,但主动靶向的纳米药物进入
服 MDR 方面显示出有效的协同效应。ZHONG 等 [22] 临床阶段的很少,值得注意的是,几种定位于转
基于聚乳酸羟基乙酸纳米粒子(PLGA NPs)、磷脂- 铁蛋白受体(TfR)的靶向纳米粒子已获批进行临
聚乙二醇(DSPE-PEG)和磷脂-聚乙二醇-叶酸 床实验 [24] 。TfR 是一种跨膜同源二聚体,在大多数
(DSPE-PEG-FA)的纳米红细胞体系(PTX/TQR 健康细胞表面普遍表达水平较低,在肿瘤细胞高表
NPs@NanoRBC-PEG/FA),用于 PTX 和 2-醛基-4- 达。转铁蛋白(Tf)是一种含 679 个氨基酸残基的
4
甲氧基苯硼酸(TQR)的联合传递,以克服乳腺癌 血清糖蛋白,相对分子质量约为 7.9×10 ,经过修
的 MDR。通过 FR 介导的内吞作用,该纳米体系将 饰与纳米药物偶联可以靶向 TfR。因此,Tf 已广泛
PTX 和 TQR 同时转运到人乳腺癌紫杉醇耐药细胞 应用于主动靶向药物。