Page 147 - 《精细化工》2023年第6期
P. 147
第 6 期 杨 欢,等: 硼碳氮纳米管的制备及靶向递送阿霉素的抗肿瘤性能 ·1297·
实验。用不同浓度(0、10、20 μmol/L)的游离 FA x
r /% 100 (4)
预处理 MDA-MB-231 细胞 1 h;然后,加入 FA- x 0
BCNNTs-DOX(DOX 质量浓度为 1 mg/L)孵育 4 h, 式中:x 为释放 t 时刻 DOX 的质量浓度,mg/L;y 为
加入 DAPI 染色 15 min 后用 PBS(pH=7.4)洗涤 3 次, 吸光度;r 为累积释放率,%;x 0 为 DOX 的初始质量
最后采用全自动倒置微分干涉显微镜观察并成像。 浓度,mg/L。
1.5.2 细胞活力测定 1.5.4 统计分析
采用 CCK8 测定体外细胞活力。将 MDA- 采用 SPSS 软件进行单因素方差分析(ANOVA)。
MB-231 细胞接种于 96 孔板中(n=3),每孔细胞数 结果以“均值±标准偏差”表示。当 P<0.05 时,为
*
4
量为 5×10 个。培养 24 h 后,分别加入不同质量浓 数据间具有显著性差异( )。
度(10、20、50、100、200 mg/L)的 FA-BCNNTs
和含不同 DOX 质量浓度(0.1、0.2、0.4、0.8、1.0 mg/L) 2 结果与讨论
的 DOX、BCNNTs-DOX、FA-BCNNTs-DOX。将细
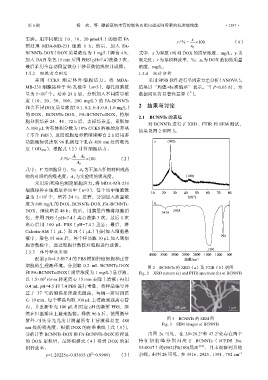
2.1 BCNNTs 的表征
胞分别培养 24、48、72 h 后,去掉培养基,重新加
对 BCNNTs 进行了 XRD、FTIR 和 SEM 测试,
入 100 μL 含有体积分数为 10% CCK8 溶液的培养基
结果见图 2 和图 3。
(不含 FBS),放回细胞培养箱继续孵育 2 h 后用多
功能酶标仪读取 96 孔板每个孔在 450 nm 处的吸光
度(OD 450 ),根据式(2)计算细胞活力:
A A
V /%= 1 0 100 (2)
A 0
式中:V 为细胞活力,%;A 0 为不加入任何材料或药
物的对照组的吸光度;A 1 为实验组的吸光度。
采用活/死染色测定细胞活力。将 MDA-MB-231
细胞接种在细胞培养皿中(n=3),每个皿中细胞数
5
量为 2×10 个,培养 24 h;接着,分别加入质量浓
度为 800 mg/L的 DOX、BCNNTs-DOX、FA-BCNNTs-
DOX,继续培养 48 h;然后,用胰蛋白酶将细胞消
化,并用 PBS(pH=7.4)离心洗涤 3 次,最后 1 次
离心后用 100 μL PBS(pH=7.4)重悬;最后,将
Calcein-AM(1 μL)和 PI(1 μL)同时加入细胞悬
液中,染色 15 min 后,每个样品取 10 μL 加入到细
胞计数板中,通过细胞计数仪对细胞进行成像。
1.5.3 体外释放实验
配制 pH=4.5 和 7.4 的 PBS 模拟肿瘤细胞和正常
细胞的生理液环境。分别取 0.2 mL BCNNTs-DOX 图 2 BCNNTs 的 XRD(a)及 FTIR(b)谱图
和 FA-BCNNTs-DOX(质量浓度为 1 mg/L)悬浮液, Fig. 2 XRD pattern (a) and FTIR spectrum (b) of BCNNTs
4
以 1.5×10 r/min 转速离心 15 min 去除上清液;再用
0.4 mL pH=4.5 和 7.4 PBS 进行重悬,将样品编号并
置于 37 ℃的恒温摇床避光振荡,每隔一定时间离
心 10 min,每个样品均取 100 μL 上清液到新离心管
内,并重新补充 100 μL 相对应 pH 的新鲜 PBS,继
续在恒温摇床上避光振荡。释放 96 h 后,使用微量
紫外-可见分光光度计测量所有上清液样品在 488 图 3 BCNNTs 的 SEM 图
Fig. 3 SEM images of BCNNTs
nm 处的吸光度,根据 DOX 的标准曲线〔式(3)〕,
分析计算 BCNNTs-DOX 和 FA-BCNNTs-DOX 所释放 由图 2a 可见,在 2θ=26.2°和 43.2°处存在两个
的 DOX 累积量,最终根据式(4)得到 DOX 的累 特 征 衍 射峰分 别对 应于 BCNNTs ( JCPDS No.
积释放率: 53-0047)的(002)和(100)晶面 [16] ,且未观察到其他
2
y=1.20225x–0.03655 (R =0.9969) (3) 杂峰。由图 2b 可见,在 3416、2925、1391、792 cm –1