Page 100 - 《精细化工》2023年第9期
P. 100
·1948· 精细化工 FINE CHEMICALS 第 40 卷
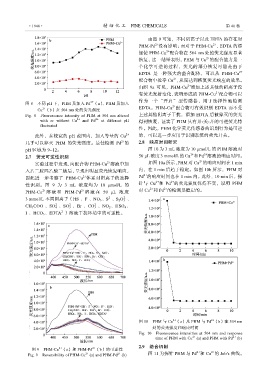
由图 9 可知,不同阴离子以及 EDTA 的存在对
2+
2+
PHM-Pd 没有影响;而对于 PHM-Cu ,EDTA 的添
2+
加使 PHM-Cu 配合物在 504 nm 处的荧光强度显著
2+
恢复,这一结果表明,PHM 与 Cu 的配合能力是一
个化学可逆的过程,荧光的部分恢复可能是由于
EDTA 是一种强大的螯合配体,可以从 PHM-Cu 2+
2+
配合物中抢夺 Cu ,从而达到恢复荧光响应的效果。
2+
由图 9a 可见,PHM-Cu 添加上述其他的阴离子没
2+
有荧光发射变化,表明形成的 PHM-Cu 配合物可以
作为一个“开启”型传感器,用于选择性地检测
2+
图 8 不同 pH 下,PHM 及加入 Pd (a)、PHM 及加入 2+
2+
Cu (b)在 504 nm 处的荧光强度 EDTA。PHM-Cu 配合物可有效识别 EDTA 而不受
Fig. 8 Fluorescence intensity of PHM at 504 nm altered 上述其他阴离子干扰,添加 EDTA 后被猝灭的荧光
2+
2+
with or without Cu and Pd at different pH 得到恢复,证实了 PHM 具有开-关-开的可逆荧光特
fluctuated
性。因此,PHM 化学荧光传感器的识别行为是可逆
此外,在较宽的 pH 范围内,加入等量的 Cu 2+ 的,可以进一步应用于识别系统的荧光开关。
2+
几乎可以猝灭 PHM 的荧光强度。最佳检测 Pd 的 2.8 响应时间研究
pH 区域为 9~12。 图 10 为 3 mL 浓度为 10 μmol/L 的 PHM 溶液对
2+
2+
2.7 荧光可逆性识别 50 μL 浓度 3 mmol/L 的 Cu 和 Pd 溶液的响应时间。
2+
2+
实验过程中发现,向配合物 PHM-Cu 溶液中加 如图 10a 所示,PHM 对 Cu 的响应时间在 1 min
入乙二胺四乙酸二钠后,呈现出明显荧光恢复响应, 内,在 1 min 后趋于稳定。如图 10b 所示,PHM 对
2+
2+
因此进一步考察了 PHM-Cu 体系对阴离子的选择 Pd 的响应时间也在 1 min 内。此外,10 min 后,探
2+
2+
性识别。图 9 为 3 mL 浓度均为 10 μmol/L 的 针与 Cu 和 Pd 的荧光强度保持不变,说明 PHM
2+
2+
2+
2+
PHM-Cu 溶液 和 PHM-Pd 溶液 在 50 μL 浓度 对 Cu 和 Pd 的检测是稳定的。
2–
–
2–
–
–
3 mmol/L 不同阴离子(HS 、F 、NO 3 、S 、S 2 O 3 、
–
–
–
2–
–
2–
2–
CH 3 COO 、SO 4 、SO 3 、Br 、CO 3 、NO 2 、HSO 4 、
–
–
2–
I 、HCO 3 、EDTA )溶液干扰环境中的可逆性。
2+
2+
图 10 PHM 与 Cu (a)及 PHM 与 Pd (b)在 504 nm
处的荧光强度和响应时间
Fig. 10 Fluorescence intensities at 504 nm and response
2+
2+
time of PHM with Cu (a) and PHM with Pd (b)
2.9 络合机制
2+
2+
图 9 PHM-Cu (a)和 PHM-Pd (b)的可逆性
2+
2+
2+
2+
Fig. 9 Reversibility of PHM-Cu (a) and PHM-Pd (b) 图 11 为探针 PHM 与 Pd 和 Cu 的 Job's 曲线。