Page 191 - 《精细化工》2023年第9期
P. 191
第 9 期 何振东,等: CaCl 2 调节银杏果分离蛋白/果胶复合凝胶质构特性 ·2039·
GSPI/DE-76%组浸出率高于 GSPI/DE-38%组,说明
蛋白更容易从前者中逸出。CaCl 2 的添加对于凝胶的
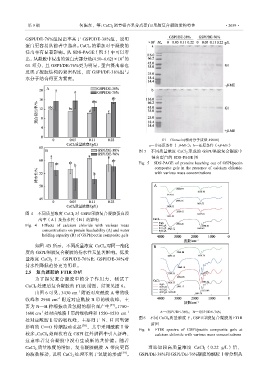
浸出率有显著影响。从 SDS-PAGE(图 5)中可以看
4
出,从凝胶中浸出的蛋白大部分是(4.50~6.62)×10 的
G1 组分,且 GSPI/DE-76%更为明显。蛋白浸出率也
反映了凝胶结构的紧密程度,而 GSPI/DE-38%组与
水分子结合得更为紧密。
G1—Ginnacin(相对分子质量 49000)
a—非还原条件(–β-ME);b—还原条件(+β-ME)
图 5 不同质量浓度 CaCl 2 形成的 GSPI/果胶复合凝胶中
浸出蛋白的 SDS-PAGE 图
Fig. 5 SDS-PAGE of proteins leaching out of GSPI/pectin
composite gels in the presence of calcium chloride
with various mass concentrations
图 4 不同质量浓度 CaCl 2 对 GSPI/果胶复合凝胶蛋白浸
出率(A)及持水性(B)的影响
Fig. 4 Effects of calcium chloride with various mass
concentrations on protein leachability (A) and water
holding capacity (B) of GSPI/pectin composite gels
如图 4B 所示,不同质量浓度 CaCl 2 对同一酯化
度的 GSPI/果胶复合凝胶的持水性无显著影响。低质
量浓度 CaCl 2 下,GSPI/DE-76%比 GSPI/DE-38%对
持水性降低趋势更为明显。
2.5 复合凝胶的 FTIR 分析
为了探究复合凝胶中的分子作用力,测试了
CaCl 2 处理后复合凝胶的 FTIR 谱图,结果见图 6。
–1
由图 6 可见,3430 cm 附近对应酰胺 A 带的吸
–1
收峰和 2960 cm 附近对应酰胺 B 带的吸收峰,主
要为 N—H 伸缩振动及氢键的耦合而产生 [37] 。1700~
–1
1600 cm 处对应酰胺Ⅰ带的吸收峰和 1550~1530 cm –1 A—GSPI/DE-38%;B—GSPI/DE-76%
图 6 不同 CaCl 2 质量浓度下,GSPI/果胶复合凝胶的 FTIR
处对应酰胺Ⅱ带的吸收峰,主要归于 N、H 间氢键
影响的 C==O 伸缩振动引起 [38] ,其中采用酰胺Ⅰ带 谱图
Fig. 6 FTIR spectra of GSPI/pectin composite gels at
较多。CaCl 2 处理没有在 GSPI 红外谱图中引入新峰, calcium chloride with various mass concentrations
这意味着复合凝胶中没有生成新的共价键。随着
CaCl 2 质量浓度的增加,复合凝胶酰胺 A 带向更高 当添加较高质量浓度 CaCl 2 (0.22 g/L)后,
的波数移动,说明 CaCl 2 处理不利于氢键的形成 [39] 。 GSPI/DE-38%和GSPI/DE-76%凝胶的酰胺Ⅰ带分别从