Page 83 - 201901
P. 83
第 1 期 郑 捷,等: 海参斑软骨多糖的纯化、结构及性质分析 ·69·
A A A 明 3 种多糖成分单一,纯度较高 [20] 。
I /% s 1 2 100 (3)
A 结合图 1 和图 2 可以看出,利用 DEAE-52 与
s
1.4.3 羟基自由基清除能力的测定 [19] Sephadex G-75 结合纯化海参斑软骨多糖,起到了较
配制 0.1、0.5、1.0、2.0、3.0、4.0、5.0 g/L 多 好的纯化效果,多糖纯化后组分均一、纯度较高。
糖溶液,取 1.0 mL 多糖溶液分别加入 1.0 mL
9 mmol/L FeSO 4 、1.0 mL 9 mmol/L 1,10-邻二氮菲和
1.0 mL 去离子水,摇匀,37 ℃下反应 30 min。对
同样质量浓度的抗坏血酸作同样处理作为阳性对
照,510 nm 下测吸光度值 A ,以蒸馏水代替多糖溶
1
液,相同条件下测吸光度值 A ,取不同质量浓度的
0
多糖溶液 1.0 mL,加入蒸馏水 3.0 mL,相同条件下
测吸光度值 A 。羟基自由基清除率( I )用式(4)
2
计算。
A A A
I /% 0 1 2 100 (4)
A 0
2 结果与讨论
2.1 海参斑软骨多糖 DEAE-52 及 Sephadex G-75
纯化结果
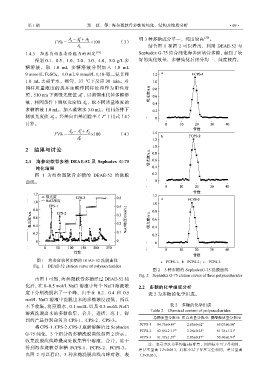
图 1 为海参斑软骨多糖的 DEAE-52 的洗脱
曲线。
图 1 海参斑软骨多糖的 DEAE-52 洗脱曲线 a—FCPS-1;b—FCPS-2;c—FCPS-3
Fig. 1 DEAE-52 elution curve of polysaccharides
图 2 3 种多糖的 SephadexG-75 洗脱曲线
Fig. 2 Sephadex G-75 elution curves of three polysaccharides
由图 1 可知,海参斑软骨多糖经过 DEAE-52 纯
化后,在 0~0.5 mol/L NaCl 溶液中每个 NaCl 溶液浓 2.2 多糖的化学组成分析
度下分别洗脱出了一个峰,由于在 0.2、0.4 和 0.5 表 2 为多糖的化学组成。
mol/L NaCl 溶液中洗脱出来的多糖浓度过低,所以
不予收集。将蒸馏水、0.1 mol/L 以及 0.3 mol/L NaCl 表 2 多糖的化学组成
Table 2 Chemical content of polysaccharides
溶液洗脱出来的多糖收集,合并,透析,冻干,得
总糖质量分数/% 蛋白质量分数/% 糖醛酸质量分数/%
到的产品分别命名为 CPS-1、CPS-2、CPS-3。
FCPS-1 94.750.49 a 2.850.62 a 65.070.50 a
将 CPS-1、CPS-2、CPS-3 重新溶解后过 Sephadex
FCPS-2 92.852.11 ab 2.260.25 a 61.781.21 a
G-75 纯化,3 个组分的多糖洗脱曲线如图 2 所示。
FCPS-3 91.471.57 b 2.050.17 a 59.400.94
b
收集洗脱曲线峰最高处收集管中溶液,合并,冻干
注:表示方法为平均值±标准差,同列标小写字母相同,
得到海参斑软骨多糖 FCPS-1、FCPS-2、FCPS-3。 差异不显著(P>0.05),肩标小写字母不完全相同,差异显著
由图 2 可以看出,3 种多糖洗脱曲线出峰对称,表 (P<0.05)。