Page 102 - 201907
P. 102
·1348· 精细化工 FINE CHEMICALS 第 36 卷
与载体的结合 [14] 。因此,本文考察了双酶固定化次 化的进行。
序对 NADH 产率的影响,结果如表 1 所示。 2.2.2 共固定化最适温度的确定
在早期实验中发现,NMN 转移酶和 ADH 在固
表 1 双酶固定化次序对 NADH 产率的影响 定化过程中最适固定化温度存在差异,而固定化温
Table 1 Effect of immobilization orders on the 度不仅影响载体与酶的结合能力,还影响酶的活力。
immobilization rate
因此,本研究考察共固定化最适温度,具体方法参
固定化次序
见 1.2.1,结果见图 2。
先固定 NMN 酶,先固定 ADH,再
双酶混合
再固定 ADH 固定 NMN 酶
NADH 产率/% 73.92 67.14 56.78
由表 1 可以看出,双酶混合共固定的 NADH 产
率为 73.92%,明显优于其他组,可能是由于逐一固
定时,首先固定的酶无规则地与载体结合,当第二
种酶固定时,剩余的醛基由于空间阻碍难以与酶结
合,从而导致 NADH 产率较低 [15] 。而混合固定法使
得两种酶与载体结合的机会均等,因此表现出更好
的催化效果。
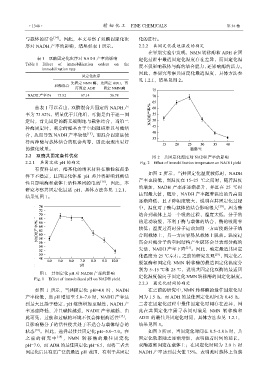
2.2 双酶共固定条件优化 图 2 共固定化温度对 NADH 产率的影响
2.2.1 共固定化 pH 的确定 Fig. 2 Effect of immobilization temperature on NADH yield
有资料显示,醛基化的纳米材料在酸性较强条
如图 2 所示,当共固定化温度较低时,NADH
件下不稳定,且固定化体系 pH 差异将影响到酶活
性且影响酶和载体上活性基团的电离 [16] ,因此,本 产率也较低,当温度在 15~25 ℃之间时,随着温度
的增加,NADH 产率亦逐渐提升,并且在 25 ℃时
研究考察共固定化最适 pH,具体方法参见 1.2.1,
达到最大值,随后,NADH 产率随着温度的升高而
结果见图 1。
逐渐降低,且下降幅度较大,说明在共固定化过程
中,温度对于酶与载体的结合影响很大 [20] 。因为酶
结合到载体上是一个吸热过程,温度太低,分子的
热运动较慢,不利于酶与载体的结合,酶的吸附率
较低;温度过高时分子运动加剧一方面使酶分子结
合到载体上,另一方面容易从载体上脱落。温度过
高会对酶分子的空间结构产生破坏会导致部分酶的
失活,NADH 产率下降 [21] 。因此,确定最适共固定
化温度为 25 ℃左右。之前的研究发现 [19] ,固定化乙
脱氢酶和固定化 NMN 转移酶的最适固定化温度分
别为 5~15 ℃和 25 ℃,说明共固定化双酶的最适固
图 1 共固定化 pH 对 NADH 产率的影响
Fig. 1 Effect of immobilized pH on NADH yield 定化温度偏向于固定化 NMN 转移酶的固定化温度。
2.2.3 固定化时间的确定
如图 1 所示,当共固定化 pH=4.0 时,NADH 在之前的研究中,NMN 转移酶的最佳固定化时
产率较低,当 pH 增加至 5.0~7.0 时,NADH 产率达 间为 1.5 h,而 ADH 的最佳固定化时间为 0.45 h,
到最大且趋于稳定,pH 继续增加至碱性,NADH 产 二者在固定化过程中最佳固定化时间存在差异,因
率迅速降低,并且碱性越强,NADH 产率越低,由 此在共固定化中需寻求同时满足 NMN 转移酶和
此可见,过酸和过碱的环境不仅会抑制酶活性 [17] , ADH 的最佳共固定化时间,具体方法参见 1.2.1,
且影响酶分子的活性使其处于不适合与载体结合的 结果见图 3。
状态 [18] 。因此,选择最佳共固定化 pH=5.0~7.0。在 如图 3 所示,当固定化时间在 0.5~2.0 h 时,共
之前的研究中 [19] , NMN 转移酶的最佳固定化 固定化效率随之逐渐增加,表明随着时间的延长,
pH=7.0,而 ADH 的最佳固定化 pH=6.5,而将二者共 双酶逐渐固定在载体上;在固定化时间为 2.0 h 时
固定化后具有更广泛的最适 pH 范围,有利于共固定 NADH 产率达到最大值 75%,表明此时载体上负载