Page 124 - 《精细化工》2020年第1期
P. 124
·110· 精细化工 FINE CHEMICALS 第 37 卷
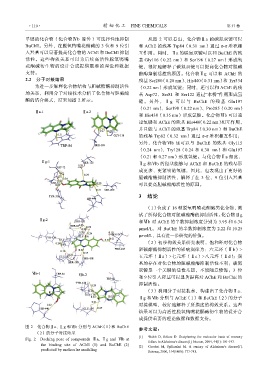
单键的化合物(化合物Ⅳb 除外)可选择性地抑制 从图 2 可以看出,化合物Ⅱa 的碳氮双键可以
BuChE。另外,在脱氧鸭嘴花酮碱的 3 位和 9 位引 和 AChE 的残基 Trp84(0.31 nm)通过 π-π 堆积相
入羟基可以显著提高化合物的 AChE 和 BuChE 抑制 互作用。同时,Ⅱa 的碳氮双键可以和 BuChE 的残
活性。这些构效关系可以为后续高活性脱氧鸭嘴 基 Gly116(0.22 nm)和 Ser198(0.27 nm)形成氢
花酮碱衍生物的设计合成提供重要的理论和数据 键,很好地解释了碳氮双键可以提高化合物对胆碱
支持。 酯酶抑制活性的原因。化合物Ⅱg 可以和 AChE 的
2.2 分子对接结果 残基 Ser200(0.20 nm)、His440(0.31 nm)和 Tyr334
为进一步解释化合物结构与胆碱酯酶抑制活性 (0.22 nm)形成氢键;同时,还可以和 AChE 的残
的关系,利用分子对接技术分析了化合物与胆碱酯 基 Asp72、Ser81 和 Ser122 通过“水桥”作用形成氢
酶的结合模式,结果如图 2 所示。 键 。另外 ,Ⅱ g 可以与 BuChE 的残 基 Glu197
(0.21 nm)、Ser198(0.22 nm)、Pro285(0.20 nm)
和 His438(0.35 nm)形成氢键。化合物Ⅵb 可以通
过氢键和 AChE 的残基 His440(0.22 nm)相互作用,
并且能与 AChE 的残基 Trp84(0.30 nm)和 BuChE
的残基 Trp82(0.32 nm)通过 π-π 堆积相互作用;
另外,化合物Ⅵb 还可以与 BuChE 的残基 Gly115
(0.24 nm)、Try128(0.24 和 0.30 nm)和 Glu197
(0.21 和 0.27 nm)形成氢键。与化合物Ⅱa 相比,
Ⅱg 和Ⅵb 的羟基能够与 AChE 和 BuChE 的残基形
成更多、更紧密的氢键,因此,也表现出了更好的
胆碱酯酶抑制活性,解释了在 3 位、9 位引入羟基
可以提高胆碱酯酶活性的原因。
3 结论
(1)合成了 16 种脱氧鸭嘴花酮碱类化合物,测
试了所得化合物对胆碱酯酶的抑制活性。化合物Ⅱg
和Ⅵb 对 AChE 的半数抑制浓度分别为 3.95 和 6.34
μmol/L,对 BuChE 的半数抑制浓度为 2.22 和 10.25
μmol/L,具有进一步研究的价值。
(2)初步构效关系研究表明,饱和环对化合物
胆碱酯酶抑制活性的影响规律为:六元环(Ⅱb)>
五元环(Ⅱa)>七元环(Ⅱc)>八元环(Ⅱd);羰
基的存在对化合物的胆碱酯酶抑制活性不利;碳氮
双键是一个关键的活性基团,不能随意修饰;3 位
和 9 位引入羟基可以显著提高对 AChE 和 BuChE 的
抑制活性。
(3)利用分子对接技术,构建出了化合物Ⅱa、
Ⅱg 和Ⅵb 分别与 AChE(1)和 BuChE(2)的分子
对接模型,较好地解释了所描述的构效关系。这些
结果可以为高活性脱氧鸭嘴花酮碱衍生物的设计合
成提供重要的理论依据和数据支持。
图 2 化合物Ⅱa、Ⅱg 和Ⅵb 分别与 AChE(1)和 BuChE
参考文献:
(2)的分子对接结果
[1] Walsh D, Selkoe D. Deciphering the molecular basis of memory
Fig. 2 Docking pose of compounds Ⅱa, Ⅱg and Ⅵb at
failure in Alzheimer's disease[J]. Neuron, 2004, 44(1): 181-193.
the binding site of AChE (1) and BuChE (2) [2] Goedert M, Spillantini M. A century of Alzheimer's disease[J].
predicted by molecular modeling
Science, 2006, 314(5800): 777-781.