Page 141 - 《精细化工》2020年第4期
P. 141
第 4 期 杨林玉,等: 兼性离子修饰亲水磁珠固定化谷胱甘肽-S-转硫酶 P1 及其表征 ·775·
2+
1.3.6 Ni -NTA 磁珠固定化对筛选及后处理条件
的稳定性
2+
筛选过程中,Ni -NTA 磁珠固定化酶在冰浴条
件下 180 r/min 振荡 1 h,磁分离取上清后加甲醇
80 ℃处理 20 min,分离磁珠和上清,甲醇样品用
N 2 挥干。设置相同蛋白量游离酶作为对照。磁珠和
甲醇样品分别加入 20 μL PBS 缓冲液和 5 μL 5×
Loading buffer,沸水浴 10 min 完全变性蛋白。利用
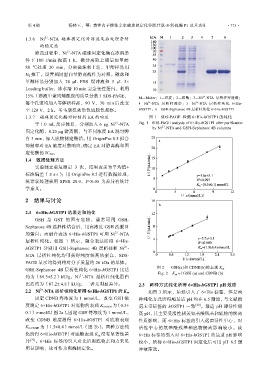
15%(溶液中聚丙烯酰胺的质量分数)SDS-PAGE, M—Maker;1—沉淀;2—粗酶;3—Ni -NTA 层析柱穿透液;
2+
每个孔道均加入等体积样品,90 V,30 min 后改变 4—Ni -NTA 层析柱洗杂; 5—Ni -NTA 层析柱纯化 6×His-
2+
2+
至 120 V,2 h。考马斯亮蓝染色后脱色观察。 hGSTP1;6—GSH-Sepharose 4B 层析柱纯化 6×His-hGSTP1
1.3.7 磁珠固定化酶对抑制剂 EA 的响应 图 1 SDS-PAGE 检测 6×His-hGSTP1 的纯化
2+
于 1.0 mL 反应体系,分别加入 6 μg Ni -NTA Fig. 1 SDS-PAGE analysis of 6×His-hGSTP1 after purification
2+
by Ni -NTA and GSH-Sepharose 4B columns
固定化酶,0.25 μg 游离酶,与不同浓度 EA 混匀孵
育 3 min,加入底物测定酶活。用 OriginPro 8.5 拟合
抑制率对 EA 浓度对数响应,确定 EA 对游离酶和固
定化酶的 IC 50 。
1.4 数据处理方法
实验独立重复测定 3 次,结果表示为平均值±
标准偏差( x );用 OriginPro 8.5 进行数据处理,
s
统计学处理采用 SPSS 20.0,P<0.05 为差异有统计
学意义。
2 结果与讨论
2.1 6×His-hGSTP1 的表达和纯化
GSH 是 GST 的固有底物,通常可用 GSH-
Sepharose 4B 选择性结合后,用高浓度 GSH 洗脱目
2+
的蛋白;而融合表达 6×His-hGSTP1 可用 Ni -NTA
层析柱纯化。如图 1 所示,融合表达所得 6×His-
2+
hGSTP1 分别用 GSH-Sepharose 4B 层析柱和 Ni -
NTA 层析柱纯化均可获得纯度较高的蛋白,SDS-
PAGE 显示均得到相对分子质量约 26 kDa 的单体。
图 2 GSH(a)和 CDNB(b)的表观 K m
GSH-Sepharose 4B 层析柱纯化 6×His-hGSTP1 比活 Fig. 2 K m of GSH (a) and CDNB (b)
2+
约为(89.5±5.2)kU/g,Ni -NTA 层析柱纯化蛋白
比活约为(87.2± 4.8)kU/g,二者无明显差异。 2.3 两种方式纯化所得 6×His-hGSTP1 pH 效应
2+
2.2 Ni -NTA 层析柱纯化所得 6×His-hGSTP1 的 K m 如图 3 所示,虽然引入了 6×His 标签,但是两
固定 CDNB 终浓度为 1 mmol/L,改变 GSH 浓 种纯化方式所得酶最适 pH 均在 6.5 附近,与文献报
度测定 6×His-hGSTP1 对底物的表观 K mGSH 为(0.3± 道未带标签的 hGSTP1 一致 [20] 。最适 pH 即活性最
0.1) mmol/L(图 2a)。固定 GSH 终浓度为 1 mmol/L, 高 pH,其主要受活性相关氨基酸残基和底物的解离
改变 CDNB 浓度测得 6×His-hGSTP1 对底物表观 性质影响,而 6×His 标签的引入远离活性中心,对
K mCDNB 为(1.5±0.4)mmol/L(图 2b)。两种方法纯 活性中心的氨基酸残基和底物解离影响较小。故
化所得 6×His-hGSTP1 对底物表观 K m 没有显著性差 6×His 标签的引入对 6×His-hGSTP1 的最适 pH 影响
异 [22] 。6×His 标签的引入对比活和底物亲和力未见 较小,所得 6×His-hGSTP1 固定化后可用 pH 6.5 缓
明显影响,故可作为靶酶固定化。 冲液筛选。