Page 142 - 《精细化工》2020年第4期
P. 142
·776· 精细化工 FINE CHEMICALS 第 37 卷
2+
2.4.2 Ni -NTA 磁珠固定化
2+
Ni -NTA 磁珠选择性地与远离活性位点中心的
N 端 6×His 标签结合,属于非共价固定化,可避免
由羧基磁珠非选择性共价固定化导致的酶活降低。
2+
如图 5 所示,150 μg Ni -NTA 磁珠饱和固载量约为
(13.8±0.3)μg 蛋白(n=3),则每 g 磁珠固载量约
为(91.9±2.3)mg 蛋白(n=3),与羧基磁珠饱和固
载量比较,约为其 1.7 倍,但此时保留酶活约为
2+
37.4%±0.5%(n=3)。当 150 μg Ni -NTA 磁珠固载
图 3 两种方式纯化 6×His-hGSTP1 的 pH 效应 量为(3.8±0.1)μg 蛋白时,即每 g 磁珠固载量约为
Fig. 3 Effect of pH on purification of 6×His-hGSTP1 with (25.6±0.9)mg 蛋白(n=3),保留酶活最高 77.5%±
2+
Ni -NTA and GSH-Sepharose 4B columns
2.7%(n=3),此时每 g 磁珠所需蛋白用量约为 30 mg。
2.4 磁珠的固定化 6×His-hGSTP1 随着固载量增加,保留活性却逐渐降低,可能与蛋
2.4.1 羧基磁珠固定化 白大量固定时空间位阻增大相关。保留酶活更高显
在 20 mmol/L 的 MES 缓冲液(pH 6.0)中,MSP- 然有利于后续的筛选,故选择蛋白投料比为 30 mg/g
COOH-F1 羧基磁珠几乎不能固定化 GSH-Sepharose 磁珠进行固定化。
4B 制备的 6×His-hGSTP1。这可能与 GSH-Sepharose
4B 纯化所得 6×His-hGSTP1 中残留 GSH 氨基竞争反
2+
应有关,且反复透析也未见改善。但 Ni -NTA 层析
柱制备的 6×His-hGSTP1 可固定于 MSP-COOH-F1
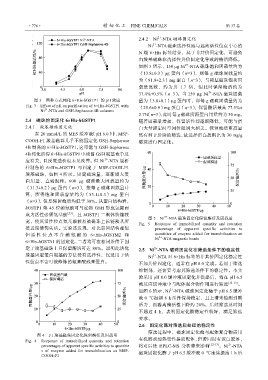
羧基磁珠,如图 4 所示。固定磁珠量,逐渐增大蛋
白用量,直到饱和。600 μg 磁珠最大固载量约为
(31.3±0.2)μg 蛋白(n=3),按每 g 磁珠固载量计
算,所得饱和固载容量约为(53.1±0.3)mg 蛋白
(n=3),但是保留酶活均低于 30%。从蛋白结构看,
hGSTP1 第 45 位赖氨酸可与底物 GSH 形成氢键而
成为活性必须氨基酸 [23] ,且 hGSTP1 二聚体狭缝较
2+
图 5 Ni -NTA 磁珠固定化保留酶活及固载量
宽,使其活性位点氨基酸较易被磁珠上长链羧基所
Fig. 5 Response of immobilized quantity and retention
接近而修饰失活。实验还发现,对比空间结构相似 percentage of apparent specific activities to
但活性位点不含赖氨酸的 6×His-hGSTM2 和 quantities of enzyme added for immobilization on
2+
Ni -NTA magnetic beads
6×His-hGSTA1 的固定化,二者均可在相同条件下固
定于羧基磁珠上且保留酶活可达 80%。说明此活化 2.5 Ni -NTA 磁珠固定化在筛选条件下的稳定性
2+
羧基固定蛋白氨基的方法没有选择性,仅适用于活 Ni -NTA 对 6×His 标签的非共价固定化稳定性
2+
性位点不含可被修饰的氨基酸残基蛋白。 不如共价固定化,通常在 pH 8.0 完成。若用于筛选
抑制剂,还需要考虑其筛选条件下的稳定性。本实
验采用 pH 8.0 缓冲液固定化并洗涤后,将在 pH 6.5
酶反应缓冲液中与配体混合物作用进行筛选 [12-13] 。
2+
如图 6 所示,Ni -NTA 磁珠固定化酶于 pH 6.5 缓冲
液 0 ℃振摇 8 h 活性保持稳定,且上清未检测到酶
活力,而游离酶活性下降约 20%。后续筛选总时间
不超过 4 h,表明固定化酶稳定性较好,满足筛选
要求。
2.6 固定化酶对筛选后处理的稳定性
筛选过程中,磁珠固定化酶与配体复合物需用
图 4 F1 羧基磁珠固定化保留酶活及固载量
Fig. 4 Response of immobilized quantity and retention 有机溶剂加热变性提取配体,但若同时有蛋白脱落,
2+
percentages of apparent specific activities to quantitie 将对后续 HPLC-MS 分析带来影响 [12-13] 。Ni -NTA
s of enzyme added for immobilization on MSP- 磁珠固定化酶于 pH 6.5 缓冲液 0 ℃连续振荡 1 h 后
COOH-F1