Page 143 - 《精细化工》2020年第4期
P. 143
第 4 期 杨林玉,等: 兼性离子修饰亲水磁珠固定化谷胱甘肽-S-转硫酶 P1 及其表征 ·777·
磁分离,甲醇 80 ℃水浴加热 20 min 变性蛋白。如 库中抑制剂。
图 7 所示,SDS-PAGE 显示甲醇处理样品挥干无肉
眼可见条带(泳道 4 和 9),表明无明显蛋白脱落。
初步证明固定化酶在筛选及后处理过程稳定性
较好。
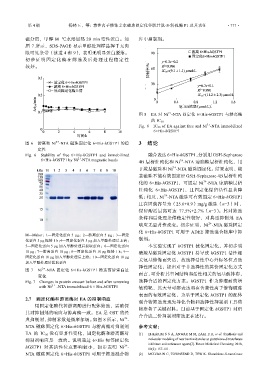
2+
图 8 EA 对 Ni -NTA 固定化 6×His-hGSTP1 与游离酶
的 IC 50
2+
Fig. 8 IC 50 of EA against free and Ni -NTA immobilized
6×His-hGSTP1
2+
图 6 游离和 Ni -NTA 磁珠固定化 6×His-hGSTP1 的稳 3 结论
定性
Fig. 6 Stability of free 6×His-hGSTP1 and immobilized 融合表达 6×His-hGSTP1,分别用 GSH-Sepharose
2+
6×His-hGSTP1 by Ni -NTA magnetic beads 4B 层析柱纯化和 Ni -NTA 琼脂糖层析柱纯化,用
2+
2+
于羧基磁珠和 Ni -NTA 磁珠固定化。结果表明,羧
基磁珠不能有效固定经 GSH-Sepharose 4B 层析柱纯
2+
化的 6×His-hGSTP1,可固定 Ni -NTA 琼脂糖层析
柱纯化 6×His-hGSTP1,且固定化保留活性显著降
2+
低;相反,Ni -NTA 磁珠可有效固定 6×His-hGSTP1
且在固载容量为(25.6±0.9)mg/g 磁珠(n=3)时,
保留酶活最高可达 77.5%±2.7%(n=3)。其对筛选
条件和后处理条件稳定性较好,对典型抑制剂 EA
2+
响应无显著性改变。初步证明,Ni -NTA 磁珠固定
化 6×His-hGSTP1 可用于 ADEE 筛选混合物库中抑
M—Maker;1—固定化蛋白 5 μg;2—游离蛋白 5 μg;3—固定
化蛋白 5 μg 振摇 1 h;4—固定化蛋白 5 μg 加入甲醇处理后上清; 制剂。
5—固定化蛋白 5 μg 加入甲醇处理后提取蛋白;6—固定化蛋白 本实验实现了 hGSTP1 优化固定化,并初步明
10 μg;7—游离蛋白 10 μg;8—固定化蛋白 10 μg 振摇 1 h;9— 确羧基磁珠固定化 hGSTP1 易导致 hGSTP1 活性相
固定化蛋白 10 μg 加入甲醇处理后上清;10—固定化蛋白 10 μg 关氨基修饰而失活,故选择活性中心外标签位点选
加入甲醇处理后提取蛋白
择性固定化;提出对于非选择性的共价固定化方式
2+
图 7 Ni -NTA 固定化 6×His-hGSTP1 筛选前后蛋白量
而言,可分析其空间结构和活性相关的氨基酸排布,
变化
Fig. 7 Changes in protein amount before and after screening 选择合适的固定化方案。hGSTP1 作为肿瘤耐药增
2 +
with Ni -NTA immobilized 6 × His-hGSTP1 敏药靶,其大量可溶表达和在含兼性离子修饰磁珠
表面的有效固定化,为基于固定化 hGSTP1 的配体
2.7 固定化酶和游离酶对 EA 的抑制响应
混合物筛选发现先导化合物和选择性抑制剂工具药
用固定化酶代替游离酶进行配体筛选,需确保
物准备了关键材料。目前基于固定化 hGSTP1 对组
其对抑制剂的响应与游离酶一致。EA 是 GST 的经 合合成二价抑制剂筛选正在进行。
2+
典抑制剂,抑制常数是微摩尔级。如图 8 所示,Ni -
NTA 磁珠固定化 6×His-hGSTP1 与游离酶对抑制剂 参考文献:
EA 的 IC 50 没有显著性变化,固定化酶和游离酶对 [1] EI-KARIM S S A, ANWAR M M, ZAKI E R, et al. Synthesis and
抑制剂响应是一致的。说明通过 6×His 标签固定化 molecular modeling of new benzimidazoles as glutathione-S-transferase
inhibitors and anticancer agents[J]. Future Medicinal Chemistry, 2018,
2+
hGSTP1 对其活性位点影响较小,初步表明 Ni - 10(2): 157-181.
NTA 磁珠固定化 6×His-hGSTP1 可用于筛选混合物 [2] MCILWAIN C, TOWNSEND D, TEW K. Glutathione-S-transferase