Page 169 - 《精细化工》2020年第7期
P. 169
第 7 期 王一彤,等: 香根草精油微胶囊的制备及其体外抗炎作用 ·1451·
–1
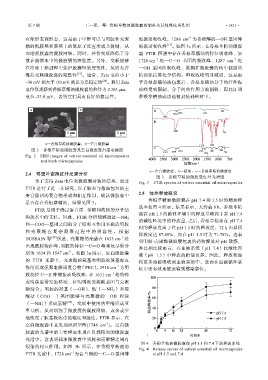
有球形表面形态,这是由于甲醛可以与明胶和壳聚 缩振动吸收峰,1286 cm 为香根醇的—OH 基团伸
糖的酰胺基和胺基上的氮原子反应形成共价键,从 缩振动吸收峰 [17] 。如图 3c 所示,在香根草精油微胶
而增强胶囊的凝胶网络。同时,共价交联降低了分 囊 FTIR 图谱中存在香根草精油的特征吸收峰,如
散在蒸馏水中的微胶囊的溶胀度。另外,交联能够 1726 cm –1 处—C==O 基团的吸收峰、1287 cm –1 处
在冷冻干燥过程中保护胶囊壁的完整性,从而允许 —OH 基团的吸收峰,推测在微胶囊的核中截留的
维持交联微胶囊的完整性 [19] 。通常,Zeta 电位小于 精油保持其化学结构。但吸收峰明显减弱,这是由
–30 mV 和大于+30 mV 被认为是稳定的 [28] 。利用 Zeta 于香根草精油被包裹后,香根草精油分子的红外振
电位仪观察到香根草精油微胶囊的粒径为 2.303 μm, 动峰受到限制,分子间的作用力被削弱,因此证明
电位–33.8 mV,表明它们具有良好的稳定性。 香根草精油成功地被封装到壁材中。
a—香根草精油微胶囊;b—空白微胶囊
图 2 香根草精油微胶囊及空白微胶囊扫描电镜图
Fig. 2 SEM images of vetiver essential oil microcapsules
and blank microcapsules
a—空白微胶囊;b—精油;c—香根草精油微胶囊
2.4 傅里叶变换红外光谱分析
图 3 香根草精油微胶囊红外光谱图
为了支持 Zeta 电位和微胶囊封装的结果,通过 Fig. 3 FTIR spectra of vetiver essential oil microcapsules
FTIR 进行了进一步研究,以了解参与精油包封的主
2.5 体外释放研究
要官能团的复合物形成和相互作用,确认微胶囊中
香根草精油微胶囊在 pH 7.4 和 1.5 时的精油释
是否存在香根草精油,结果见图 3。
放率如图 4 所示。结果显示,大约前 8 h,香根草精
FTIR 是用于确定蛋白质、多糖和药物的分子结
油在 pH 1.5 的酸性环境中的释放量略高于在 pH 7.4
构技术中的支柱。因此,FTIR 分析能够通过—NH 2
的碱性环境中的释放量,之后,香根草精油在 pH 7.4
和—COO—基团之间的分子间相互作用来确认明胶
时的释放度高于在 pH 1.5 时的释放度,72 h 内累积
和 壳聚糖 在复 杂凝聚 过程 中的相 容性 。根 据
释放度达 87.49%,而在 pH 1.5 时为 71.78%。这表
–1
HUSSAIN 等 [29] 所述,壳聚糖的光谱在 1633 cm 处
明明胶-壳聚糖微胶囊包裹的药物释放对 pH 敏感,
出现酰胺特征峰,明胶的特征—C==O 峰和氨基带分
并且相比较而言,在血液系统(pH 7.4)比酸性胃
–1
别为 1624 和 1547 cm 。如图 3a 所示,空白微胶囊
液(pH 1.5)中释放的精油更多。因此,释放精油
的 FTIR 光谱中,壳聚糖的氨基和明胶的羧基相互 将更多地被吸收到血液系统中,进而在血液循环系
–1
作用形成强聚电解质复合物(PEC)。2918 cm 为明 统中更有效地被运输到感染部位。
–1
胶烷烃 C—H 伸缩振动吸收峰,在 1631 cm 处的峰
表明羰基带发生移动,证明明胶的羧酸基团与壳聚
糖缔合。明胶的羟基(—OH)、胺(—NH 2 )和羧
酸盐(COO—)基团能够与壳聚糖的—OH 和铵
+
(—NH 3 )形成氢键 [30] 。交联中使用的甲醛形成亚
甲基桥,从而增强了微胶囊的凝胶网络,或多或少
地改变了肽基吸收带的幅度和强度。FTIR 显示,在
-1
空白微胶囊中未发现残留甲醛(1746 cm )。空白微
胶囊的光谱中的主要峰也出现在负载精油的微胶囊
光谱中。这表明载油微胶囊中明胶和壳聚糖之间有
图 4 香根草精油微胶囊在 pH 1.5 和 7.4 下的释放曲线
很强的相互作用。如图 3b 所示,在香根草精油的
Fig. 4 Release curves of vetiver essential oil microcapsules
–1
FTIR 光谱中,1728 cm 为岩兰酮的—C==O 基团伸 at pH 1.5 and 7.4