Page 223 - 《精细化工》2020年第7期
P. 223
第 7 期 赵惠霞,等: MCPVT 测定 1,3-丁二烯氧化动力学 ·1505·
中,可以认为 1,3-丁二烯浓度远远大于氧气浓度, 6.75、lnk p =–3018/T+3.43、lnk p =–3202 /T+6.87。计算
反应过程中消耗 1,3-丁二烯的量与初始 1,3-丁二烯 得到的活化能分别为 30.50、25.09、26.62 kJ/mol。
的量相差不大,可假设 1,3-丁二烯的浓度是恒定的, 对 3 种条件下活化能进行比较可以得出,1,3-丁二烯
m
即[A] 为常数。 在氧气条件下性质比较活泼,易发生反应。
假设氧化初期动力学是假一级反应,即 n=1,
公式推导过程与氧气过量情况类似。
1,3-丁二烯氧化反应分别在温度为 343.15、
353.15、363.15、373.15 和 383.15 K 时作 lnp-t 曲线,
结果如图 7 所示。
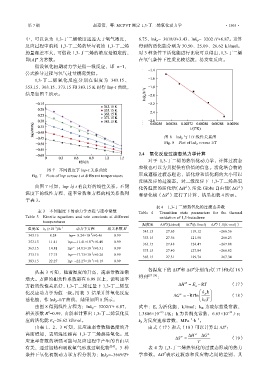
图 8 lnk p 与 1/T 线性关系图
Fig. 8 Plot of lnk p versus 1/T
2.4 氧化反应过渡态热力学计算
对于 1,3-丁二烯的热氧化动力学,计算过渡态
参数也可以为其提供有价值的信息。活化络合物的
图 7 不同温度下 lnp-t 关系曲线
Fig. 7 Plots of lnp versus t at different temperatures 形成遵循过渡态理论,活化焓和活化熵的大小可以
反映反应的过渡态。对二级反应下 1,3-丁二烯热氧
由图 7 可知,lnp 与 t 有良好的线性关系。不同 化各温度的活化焓(ΔH )、活化 Gibbs 自由能(ΔG )
≠
≠
温度下的线性方程、速率常数和方程的相关系数列 和活化熵(ΔS )进行了计算,结果如表 4 所示。
≠
于表 3。
表 4 1,3-丁二烯热氧化的过渡态参数
表 3 不同温度下的动力学方程与速率常数 Table 4 Transition state parameters for the thermal
Table 3 Kinetic equations and rate constants at different oxidation of 1,3-butadiene
temperatures
≠
≠
≠
温度/K ΔH /(kJ/mol) ΔG /(kJ/mol) ΔS /〔J/(K·mol)〕
–2
–1
温度/K k p (×10 )/h 动力学方程 相关系数 R 2
343.15 27.65 119.12 –266.56
–2
343.15 8.24 lnp=–8.24×10 t+0.46 0.99
353.15 27.56 121.58 –266.23
–2
353.15 11.41 lnp=–11.41×10 t+0.40 0.99
363.15 27.48 124.47 –267.08
363.15 14.81 lnp=–14.81×10 t+0.31 0.99
–2
373.15 27.40 127.04 –266.02
–2
373.15 17.73 lnp=–17.73×10 t+0.26 0.99
383.15 27.31 129.74 –267.34
–2
383.15 22.27 lnp=–22.27×10 t+0.19 0.99
各温度下的 ΔH 和 ΔG 分别由式(17)和式(18)
≠
≠
从表 3 可知,随着温度的升高,速率常数逐渐
得到 [25-26] :
增大。方程的相关性系数都在 0.99 以上,说明速率
方程的线性关系好,1,3-丁二烯过量下 1,3-丁二烯氧 H E a RT (17)
化反应动力学为假一级。用表 3 结果计算氧化反应 k p h
G RlnT (18)
B
活化能,作 lnk p -1/T 曲线,结果如图 8 所示。 k T
由图 8 得到线性方程为:lnk p =–3202/T+ 6.87, 式中:E a 为活化能,kJ/mol;k B 为玻尔兹曼常数,
2
相关系数 R =0.99,由斜率计算出 1,3-丁二烯氧化反 1.3806×10 –23 J/K;h 为普朗克常数,6.63×10 –34 J·s;
–1
–1
应的活化能 E a =26.62 kJ/mol。 k p 为反应速率常数,MPa ·h 。
≠
由表 1、2、3 可知,反应速率常数随温度的升 由式(17)和式(18)可以计算出 ΔS :
高而增加,表明温度越高 1,3-丁二烯越易氧化。反 H G
应速率常数的增强可能与反应过程中产生的自由基 S T (19)
有关,通过加热和吸收氧气形成过氧化物 [24] 。3 种 表 4 为 1,3-丁二烯热氧化的过渡态形成的热力
≠
条件下氧化初期动力学方程分别为:lnk p =–3669/T+ 学参数。ΔG 表示过渡态和反应物之间的差别,其