Page 144 - 《精细化工》2022年第11期
P. 144
·2294· 精细化工 FINE CHEMICALS 第 39 卷
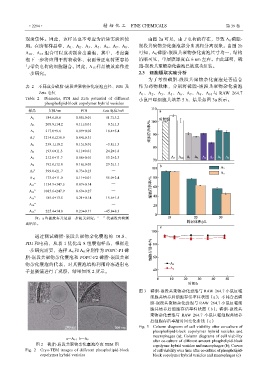
现聚集体。因此,该样品也不考虑为后续实验所使 由图 2a 可见,由于电荷的存在,导致 A 6 磷脂-
用。在所有样品中,A 1 、A 2 、A 3 、A 5 、A 6 、A 7 、A 8 、 嵌段共聚物杂化囊泡部分出现相分离现象。由图 2b
A 10 、A 15 组合可以成功制备出囊泡,其中,考虑囊 可知,A 8 磷脂-嵌段共聚物杂化囊泡尺寸均一,结构
泡下一步将应用于药物载体,表面带正电荷更容易 清晰可见,单层膜厚度在 6 nm 左右。由此证明,磷
与带负电荷的细胞融合。因此,A 15 样品被放弃作进 脂-嵌段共聚物杂化囊泡已被成功组装。
一步研究。 2.3 细胞摄取实验分析
为了考察磷脂-嵌段共聚物杂化囊泡是否适合
表 2 不同成分磷脂-嵌段共聚物杂化囊泡直径、PDI 及 作为药物载体,分别将磷脂-嵌段共聚物杂化囊泡
Zeta 电位 A 1 、A 2 、A 3 、A 5 、A 6 、A 7 、A 8 、A 10 与 RAW 264.7
Table 2 Diameter, PDI and Zeta potential of different 小鼠巨噬细胞共培养 5 h,结果如图 3a 所示。
phospholipid-block copolymer hybrid vesicles
样品 直径/nm PDI Zeta 电位/mV
184.6±8.6 0.08±0.01 11.7±3.2
A 1
A 2 208.9±14.2 0.11±0.01 0.5±1.3
A 3 217.0±9.6 0.09±0.02 18.4±5.4
a
A 4 1214.0±230.9 0.84±0.31 —
239.1±10.2 0.15±0.01 –3.8±1.3
A 5
193.6±11.3 0.11±0.01 24.2±1.8
A 6
A 7 212.0±11.7 0.08±0.01 53.2±2.3
A 8 192.0±12.8 0.16±0.03 29.5±1.1
a
A 9 399.0±21.7 0.73±0.23 —
173.4±11.0 0.11±0.01 55.0±2.4
A 10
a —
A 11 1154.9±347.5 0.87±0.14
a —
A 12 1085.6±247.9 0.69±0.27
a
A 13 185.4±13.5 0.21±0.14 15.6±1.5
a
A 14 — — —
a
A 15 225.4±14.8 0.23±0.11 –45.8±8.3
注:a 均被放弃开展进一步相关研究;“—”代表没有检测
出结果。
通过测试磷脂-嵌段共聚物杂化囊泡的 DLS、
PDI 和电荷,从表 1 优化出 8 组囊泡样品,根据进
一步研究需要,选择 A 6 和 A 8 分别作为 POPC-P1 磷
脂-嵌段共聚物杂化囊泡和 POPC-P2 磷脂-嵌段共聚
物杂化囊泡的代表,对其囊泡结构利用冷冻透射电
子显微镜进行了观察,结果如图 2 所示。
图 3 磷脂-嵌段共聚物杂化囊泡与 RAW 264.7 小鼠巨噬
细胞共培养后细胞存活率柱状图(a);不同含量磷
脂-嵌段共聚物杂化囊泡与 RAW 264.7 小鼠巨噬细
胞共培养后细胞存活率柱状图(b);磷脂-嵌段共
聚物杂化囊泡与 RAW 264.7 小鼠巨噬细胞共培养
后细胞存活率随时间变化曲线(c)
Fig. 3 Column diagrams of cell viability after co-culture of
phospholipid-block copolymer hybrid vesicles and
macrophages (a); Column diagrams of cell viability
a—A 6;b—A 8 after co-culture of different amount phospholipid-block
图 2 磷脂-嵌段共聚物杂化囊泡冷冻 TEM 图 copolymer hybrid vesicles and macrophages (b); Curves
Fig. 2 Cryo-TEM images of different phospholipid-block of cell viability over time after co-culture of phospholipid-
copolymer hybrid vesicles block copolymer hybrid vesicles and macrophages (c)