Page 119 - 《精细化工》2022年第4期
P. 119
第 4 期 赵 丹,等: 乳酸菌发酵提取物保护皮肤氧化损伤的作用与机理 ·755·
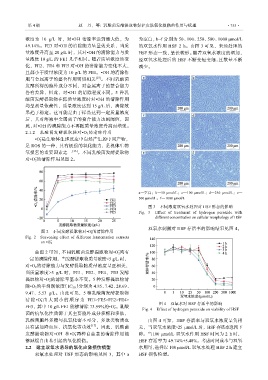
浓度为 10 g/L 时,对•OH 清除率达到最大值,为 为空白,b~f 分别为 50、100、250、500、1000 μmol/L
49.14%。FE3 对•OH 的清除能力呈量效关系,当质 的双氧水作用 HSF 2 h。由图 3 可见,未经处理的
量浓度升高至 20 g/L 时,其对•OH 的清除能力与质 HSF 形态一致,呈长梭形。随着双氧水浓度的增加,
量浓度 10 g/L 的 FE1 几乎相同。随着质量浓度的变 经双氧水处理后的 HSF 不断变短变细,且数量不断
化,FE2、FE4 和 FE5 对•OH 的清除能力变化不大, 减少。
且都小于质量浓度为 10 g/L 的 FE1。•OH 的清除作
用与金属离子的螯合作用密切相关 [15] 。不同乳酸菌
发酵所得的胞外成分不同,对金属离子的螯合能力
各有差异,因此,对•OH 的清除程度不同。5 种乳
酸菌发酵提取物在低质量浓度时对•OH 的清除作用
均呈剂量依赖性,质量浓度达到 15 g/L 后,清除效
果趋于稳定。这可能是由于样品达到一定质量浓度
后,其对溶液中金属离子的螯合能力达到阈值,因
此,对•OH 的清除能力不再随质量浓度升高而增强。
–
2.1.2 乳酸菌发酵提取物对•O 2 的清除作用
–
•O 2 是生物体生理反应中自然产生的中间产物,
是 ROS 的一种,具有极强的氧化能力,是机体生物
氧损害的重要因素之一 [16] 。不同乳酸菌发酵提取物
–
对•O 2 的清除作用见图 2。
a—空白;b—50 μmol/L;c—100 μmol/L;d—250 μmol/L;e—
500 μmol/L;f—1000 μmol/L
图 3 不同浓度双氧水处理对 HSF 形态的影响
Fig. 3 Effect of treatment of hydrogen peroxide with
different concentration on cellular morphology of HSF
双氧水刺激对 HSF 存活率的影响结果见图 4。
–
图 2 不同发酵提取物对•O 2 的清除作用
Fig. 2 Scavening effect of different fermentation extracts
–
on •O 2
–
由图 2 可知,不同乳酸菌发酵提取物对•O 2 均有
一定的清除作用,当发酵提取物质量浓度<5 g/L 时,
–
对•O 2 的清除能力与发酵提取物质量浓度呈正相关,
当质量浓度>5 g/L 时,FE1、FE2、FE4、FE5 发酵
–
提取物对•O 2 的清除率基本不变。5 种发酵提取物清
–
除•O 2 的半抑制浓度(IC 50 )分别为 4.85、7.42、28.69、
9.47、5.53 g/L。由此可见,5 种乳酸菌发酵提取物
–
清除 •O 2 由大 到 小 的顺序 为 FE1>FE5>FE2>FE4>
–
FE3,其中 10 g/L FE1 能够清除 73.99%的•O 2 。乳酸 图 4 双氧水对 HSF 存活率的影响
Fig. 4 Effect of hydrogen peroxide on viability of HSF
菌的抗氧化性质源于其主要胞外成分多糖和多肽,
乳酸菌胞外多糖与抗氧化密不可分,多肽类物质也 由图 4 可知,HSF 存活率与双氧水浓度呈负相
具有诸如降血压、抗氧化等功效 [17] 。因此,乳酸菌 关,当双氧水浓度>25 μmol/L 时,HSF 存活率急剧下
–
发酵提取物对•OH 和•O 2 两种自由基的清除作用能 降。当 100 μmol/L 双氧水作用 HSF 时间为 2 h 时,
够减缓自由基引起的氧化损伤。 HSF 存活率为 49.74%±5.48%。考虑时间成本与双氧
2.2 建立双氧水诱导的氧化应激损伤模型 水用量,选择以 100 μmol/L 双氧水处理 HSF 2 h 建立
双氧水处理对 HSF 形态的影响见图 3,其中 a HSF 损伤模型。