Page 137 - 《精细化工》2022年第6期
P. 137
第 6 期 侯祎苗,等: Mn-Co 尖晶石催化氧化乙酸乙酯 ·1203·
Mn 1 Co 1 O x 具有较高的催化氧化活性。 管式炉原位再生,在管式炉中使用的催化剂不移动,
400 ℃活化 1 h,然后将催化剂再重新进行乙酸乙酯的
氧化反应,发现去除效率的变化很小。以上结果说明,
Mn 1Co 1O x 催化剂具有较好的稳定性和可重复利用性。
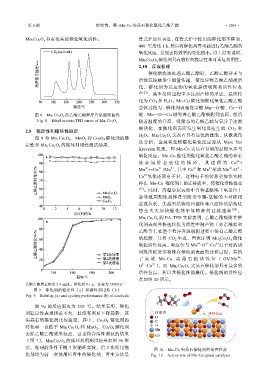
2.10 反应机理
催化燃烧法处理乙酸乙酯时,乙酸乙酯分子与
活性氧接触发生能量传递,使反应物乙酸乙酯被活
化,催化剂为反应物的氧化提供吸附和活性位点
[26-27]
,减少反应过程中不良副产物的形成,最终转
化为 CO 2 和 H 2 O。Mn-Co 催化剂催化氧化乙酸乙酯
总体过程为:催化剂表面化学键 Mn—O 键、Co—O
图 8 Mn 1 Co 1 O x 的乙酸乙酯程序升温脱附曲线 键、Mn—O—Co 键等将乙酸乙酯吸附到表面,然后
Fig. 8 Ethyl acetate-TPD curve of Mn 1 Co 1 O x 随着温度的升高,吸附态的乙酸乙酯与氧分子逐渐
被活化,在催化剂表面发生氧化反应生成 CO 2 和
2.9 稳定性和循环性测定
H 2 O。Mn 1 Co 1 O x 尖晶石具有最优的性能,从微观角
图 9 为 Mn 1 Co 1 O x 、MnO 2 和 Co 3 O 4 催化剂的稳
度分析,金属氧化物催化氧化反应遵从 Mars Van
定性和 Mn 1 Co 1 O x 的循环利用性测试结果。
Krevelen 机理,即 Mn-Co 尖晶石骨架的晶格氧参与
氧化反应。Mn-Co 催化剂催化氧化乙酸乙酯的核心
2+
是金属价 态变化的 循环,其 过程为 Co +
3+
3+
4+
4+
2−
2+
4+
Mn ↔Co +Mn ,其中 Co 和 Mn 形成 Mn -O -
2+
Co 氧化还原电子对,这种电子的转移会加快氧物
种在 Mn-Co 催化剂上的迁移速率,使催化活性提高
[23]
。同时,高温金属运动中肖特基缺陷(氧空位)
会导致周期性晶体骨架附近金属-氧键的不对称扭
曲或拉长,尖晶石结构的四面体和八面体的结构优
势会大大加快催化剂中氧物种的迁移速率 [28] 。
Mn 1 Co 1 O x 的 EA-TPD 实验表明,乙酸乙酯吸附在催
化剂表面并快速转化为活性中间产物(如乙酸盐和
乙醛等),在整个程序升温脱附过程中没有乙酸乙酯
的脱附,只有 CO 2 生成,再次证明 Mn 1 Co 1 O x 催化
2−
2+
4+
氧化活性较高。氧空位与 Mn -O -Co 电子对的协
同效应促进氧物种在催化剂表面的迁移过程,共筑
4+
了高效 Mn-Co 尖晶石的活性 位( OV-Mn -
2−
2+
O -Co ),而 Mn 1 Co 1 O x 尖晶石催化剂具有最多的
活性位点,所以其催化性能最优。催化剂的活性位
点如图 10 所示。
–1
乙酸乙酯质量浓度 3.9 mg/L;催化剂 0.1 g,空速为 35000 h
图 9 催化剂的稳定性(a)和循环利用性(b)
Fig. 9 Stability (a) and cycling performance (b) of catalysts
图 9a 的反应温度为 210 ℃。结果表明,催化
剂稳定性表现相差不大,且没有明显下降趋势,该
尖晶石型催化剂比较稳定,其中,Co 3 O 4 催化剂的
转化率一直低于 Mn 1 Co 1 O x 和 MnO 2 ,Co 3 O 4 催化剂
去除乙酸乙酯效果较差,这也符合活性测试的结果
(图 7)。Mn 1 Co 1 O x 的循环利用测试结果如图 9b 所
示,相同的条件下做 3 次循环实验,后 2 次所用催
图 10 Mn-Co 尖晶石催化剂的活性位点
化剂均为前一次使用后再生的催化剂,再生方法是 Fig. 10 Active site of Mn-Co spinel catalysts