Page 125 - 201903
P. 125
第 3 期 雷 蕾,等: 复合酶协同超声提取藜麦皂苷及其抗氧化性 ·471·
式中:A 0 为空白对照实验测定的吸光度,即未加样
品的 DPPH·吸光度(DPPH·溶液+溶剂);A 1 为样品
组测定的吸光度,即加入样品反应平衡后的吸光度
(DPPH·溶液+样品溶液);A 2 为干扰组测定的吸光
度,即样品本身的吸光度(样品溶液+溶剂)。
2 结果与讨论
2.1 单因素实验
2.1.1 纤维素酶用量对藜麦皂苷提取率的影响
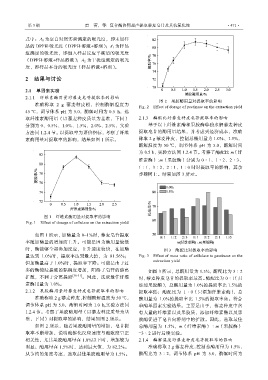
图 2 果胶酶用量对提取率的影响
准确称取 2 g 藜麦种皮粉,控制酶解温度为
Fig. 2 Effect of dosage of pectinase on the extraction yield
45 ℃,调节体系 pH 为 5.0,酶解时间为 0.5 h,选
取纤维素酶用量(以藜麦种皮质量为基准,下同) 2.1.3 酶配比对藜麦种皮皂苷提取率的影响
分别为 0、0.5%、1.0%、1.5%、2.0%、2.5%,实验 基于以上纤维素酶和果胶酶单独水解藜麦种皮
方法同 1.2.4 节。以提取率为评价指标,考察了纤维 提取皂苷的酶用量结果,并考虑到经济成本,准确
素酶用量对提取率的影响,结果如图 1 所示。 称取 2 g 藜麦种皮,控制总酶用量为 1.0%、1.5%,
酶解温度为 50 ℃,调节体系 pH 为 5.0,酶解时间
为 0.5 h,实验方法同 1.2.4 节。考察了酶配比 m(纤
维素酶)∶m(果胶酶)分别为 0∶1、1∶2、2∶3、
1∶1、3∶2、2∶1、1∶0 时对提取率的影响,其余
步骤同上。结果如图 3 所示。
图 1 纤维素酶用量对提取率的影响
Fig. 1 Effect of dosage of cellulase on the extraction yield
如图 1 所示,加酶量为 0~1%时,藜麦皂苷提取
率随加酶量的增加而上升。可能是因为酶用量较低
时,酶能够全部参加反应,上升速度较快,在加酶 图 3 酶配比对提取率的影响
量达到 1.0%时,提取率达到最大值,为 81.56%; Fig. 3 Effect of mass ratio of cellulase to pectinase on the
extraction yield
但加酶量高于 1.0%时,提取率下降。可能是由于过
多的酶使浸提液的黏稠度增加,阻碍了皂苷的游离 如图 3 所示,总酶用量为 1.5%,酶配比为 3∶2
扩散,不利于分离提取 [30-31] 。因此,选取最佳纤维 时,藜麦种皮皂苷的提取率最高。酶配比为 0∶1(只
素酶用量为 1.0%。 添加果胶酶),总酶用量为 1.0%的提取率比 1.5%的
2.1.2 果胶酶用量对藜麦种皮皂苷提取率的影响 提取率低;酶配比为 1∶0(只添加纤维素酶),总
准确称取 2 g 藜麦种皮,控制酶解温度为 50 ℃, 酶用量为 1.0%的提取率比 1.5%的提取率高。符合
调节体系 pH 为 5.0,酶解时间为 1.0 h,实验方法同 单酶单因素实验结果。主要是由于,藜麦种皮中含
1.2.4 节。考察了果胶酶用量(以藜麦种皮质量为基 有大量的纤维素以及果胶质,添加纤维素酶以及果
准,下同)对提取率的影响,结果如图 2 所示。 胶酶促进了皂苷向溶剂中的扩散。因此,选取最佳
如图 2 所示,随着果胶酶用量的增加,皂苷提 总酶用量为 1.5%,m(纤维素酶)∶m(果胶酶)
取率不断增加,说明酶催化反应速度与酶浓度呈正 =3∶2 进行后续实验。
相关性,尤其果胶酶用量在 1.0%以下时,增加较为 2.1.4 酶解温度对藜麦种皮皂苷提取率的影响
明显;酶用量在 1.5%时,达到最大值,为 82.2%。 准确称取 2 g 藜麦种皮,控制总酶用量为 1.5%,
从节约的角度考虑,选取最佳果胶酶用量为 1.5%。 酶配比为 3∶2,调节体系 pH 为 5.0,酶解时间为