Page 40 - 《精细化工》2020年第5期
P. 40
·890· 精细化工 FINE CHEMICALS 第 37 卷
WANG 等 [63] 制备了一种多功能的纳米药物载
体,该载体为核壳结构,其内核为上转换纳米粒子
3+
3+
3+
(UCNPs—NaYF 4 :20%Yb ,2%Er /NaGdF 4 :2%Yb ),
用于上转换/计算机断层扫描/核磁共振三模态成
像(UCL/CT/MRI),外壳为介孔二氧化硅,氧化
锌作为“看门人”(图 14)。研究表明,制备得到
的多功能纳米药物载体能够有效地将 3 种成像模
态结合在一起,实现了体内外的三模态成像,为
肿瘤的诊断提供了更多综合信息。更为重要的是,
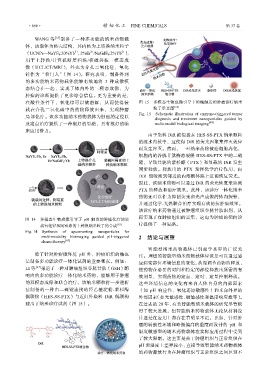
在酸性条件下,氧化锌可以被溶解,从而使得装 图 15 多模态生物成像引导下的酶触发的肿瘤诊疗纳米
载在介孔二氧化硅中的药物释放出来,实现肿瘤 粒子示意图 [64]
Fig. 15 Schematic illustration of emzyme-triggered tumor
局部化疗。该多功能纳米药物载体为肿瘤的定位以 diagnosis and treatment nanoparticles guided by
及定点治疗提供了一种很好的思路,具有很好的临 multi-modal biological imaging [64]
床应用潜力。
由于染料 DiR 被包裹在 HES-SS-PTX 纳米颗粒
的疏水内核中,这使得 DiR 的荧光因聚集淬灭效应
而发生淬灭。然而,一旦纳米药物被癌细胞内化,
细胞内的谷胱甘肽酶将裂解 HES-SS-PTX 中的二硫
键,导致共轭的紫杉醇(PTX)和负载的 DiR 发生
同步释放。释放出的 PTX 发挥化学治疗作用,而
DiR 能吸附到邻近的内溶酶体膜上进而恢复荧光。
因此,该纳米药物可以通过 DiR 的荧光恢复来监测
PTX 的释放和治疗效果。此外,该诊疗一体化纳米
药物还可以作为抑制荧光和光声成像的体内探针,
并通过化学-光热联合治疗实现有效的抗肿瘤效果。
该诊疗纳米药物通过被肿瘤组织谷胱甘肽识别,从
图 14 多模态生物成像引导下 pH 触发的肿瘤化疗的转 而实现了在肿瘤组织的富集,这也为肿瘤的靶向诊
载氧化锌和阿霉素的上转换纳米粒子的合成 [63] 疗提供了一种思路。
Fig. 14 Synthesis of upconverting nanoparticles for
multi-modality bioimaging guided pH-triggered 2 结论与展望
chemotherapy [63]
智能型纳米药物载体已引起学术界的广泛关
除了针对肿瘤微环境 pH 外,肿瘤组织的酶也 注。理想的智能型纳米药物载体应该是可以通过感
是制备多功能诊疗一体化试剂的重要靶点。例如: 应病变部位环境信息的变化,从而调节药物的释放,
LI 等 [64] 报道了一种对肿瘤组织谷胱甘肽(GSH)酶 使药物在必要的时间和特定的部位释放出所需的有
响应的多功能诊疗一体化纳米药物,能够用于肿瘤 效剂量,实现药物的定点、定时、定量控制释放。
的双模态成像和联合治疗。该纳米颗粒将一步透析 这些环境信息的变化有来自人体自身的内部因素
法制备的一种由二硫键连接的羟乙基淀粉-紫杉醇 (如 pH 响应性、氧化还原敏感性)和来自外界的
偶联物(HES-SS-PTX)与近红外染料 DiR 偶联构 外部因素(如光敏感性、磁敏感性和温度响应性等)。
建出了纳米诊疗试剂(图 15)。 在过去的 20 年,有关智能型纳米载体的研究尽管取
得了较大进展,但智能纳米药物载体无论从材料设
计还是在应用上都存在着明显不足。比如,针对肿
瘤的弱酸性环境和略微偏高的温度而设计的 pH 和
温度敏感型的纳米药物载体在实际应用过程中受到
了较大限制。这主要是由于肿瘤组织与正常组织在
pH 和温度上差异较小,直接导致智能纳米药物载体
的药物释放行为在肿瘤组织与正常组织之间区别不