Page 33 - 《精细化工》2022年第10期
P. 33
第 10 期 王瑞雪,等: 水分解制氢中的电解液调控机制 ·1967·
效大小、溶液黏度以及物质的浓度 3 个主要参数来控 逆反应都是多质子-电子转移反应,前面提到,涉及
制整体传质通量,这些值取决于电解液的性质。因此, 电子和质子转移的反应可以通过涉及单独电子转移
电解液中离子的性质对质量输运也有很大的影响。 或单独质子转移的逐步路径进行,或者通过不含中
对流是由溶液内压力不平衡引起的物质传输。 间物的协同路径进行,即质子耦合电子转移 [38] ,HER
气体产物产生气泡后可能在小范围内引起物质传 通常包括 Volmer、Heyrovsky 和 Tafel 步骤。
输,但较为明显的对流现象往往需要施加外部搅拌,
在电催化中,常用旋转圆盘电极研究电化学系统中
的质量传递。在旋转圆盘电极构型下,扩散通量和
对流通量由 Levich 方程描述:
j 062 F. n ω 12/ v 1 6/ D 2 3/ δc (21)
L i
式中:j L 为极限扩散电流密度(即 Levich 电流密度),
2
mA/cm ;n 为参与电化学反应的电子数;ω 为圆盘
2
电极的转速,rad/s;v 为溶液的运动黏度,m /s;δc i
为表面和体相之间的浓度差,mol/L。由式(21)可
得到描述表面扩散层的公式为:
δ 162. ω 12 1 6/ v / D 1 3/ (22)
在旋转圆盘电极中,可以通过精确控制扩散层
厚度来控制质量输运。当不使用旋转圆盘电极时,
即反应器内溶液无外部动力输入,只存在自然对流,
此时电极表面扩散层的厚度将比旋转圆盘电极构型
下的扩散层厚度大几个数量级。
2 电解液调控机制
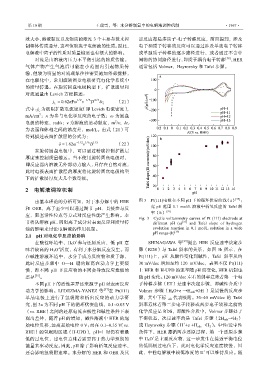
由基本理论的分析可知,对于水分解中的 HER 图 3 Pt(111)电极在不同 pH 下的循环伏安曲线(a) [37] ;
和 OER,离子至少可以通过调节 pH、直接参与反 宽 pH 范围 0.1 mol/L 溶液中析氢反应的 Tafel 斜
率(b) [39]
应、阻塞活性位点等方式对反应性能产生影响。本
Fig. 3 Cyclic voltammetry curves of Pt (111) electrode at
节将从溶液 pH、阴阳离子成分对表面反应和质量传 different pH (a) [37] and Tafel slope of hydrogen
输的影响来讨论电解液的作用机制。 evolution reaction in 0.1 mol/L solution in a wide
pH range (b) [39]
2.1 pH 对电化学反应的影响
+
在酸性环境中,H 3 O 参与还原反应,低 pH 意 SHINAGAWA 等 [39] 提出 HER 反应速率决定步
+
味着较高的 H 3 O 活度,有利于水分解反应发生。而 骤(RDS)与 Tafel 斜率的关系,如图 3b 所示,在
在碱性溶液环境中,水分子成为反应物和质子源, Pt(111)上,pH 从酸性变化到碱性,Tafel 斜率从约
此时反应步骤中 O—H 键的解离在动力学上更缓 30 mV/dec 增加至约 120 mV/dec,表明不仅 Pt(111)
慢,即不同 pH 下反应物的不同会导致反应性能的 上 HER 和 H-UPD 的速率随 pH 而变化,HER 机制也
差异 [35] 。 随 pH 变化。120 mV/dec 左右的斜率意味着第一个电
不同 pH 下的活性差异还来源于 pH 对表面反应 子转移步骤(ET)是速率决定步骤,即碱性介质中
–
–
动力学的影响。LEDEZMA-YANEZ 等 [37] 在 Pt(111) Volmer 步骤(H 2O+e →H ads +OH )是最慢的反应步
单晶电极上进行了氢吸附和析出反应的动力学研 骤,其中下标 ads 代表吸附。30~40 mV/dec 的 Tafel
究,图 3a 为不同 pH 下的循环伏安曲线,–0.1~0.05 V 斜率意味着第二步电子转移或两步电子转移之前的
(vs. RHE)之间的还原电流在酸性和碱性条件下表 化学反应是 RDS,即酸性介质中,Volmer 步骤处于
现出差异,随着 pH 的增加,碱性溶液中 HER 的起 平衡状态,决定速率的是 Tafel 步骤(2H ads →H 2 )
+
–
始电位负移,远离起始电位 0 V;而在 0.1~0.35 V(vs. 或 Heyrovsky 步骤(H +e +H ads →H 2 )。中性/近中性
RHE)的氢吸附区域(H-UPD),pH=1 时仍有着最 条件下,HER 遵循两步还原过程,第一个还原步骤
+
低的过电位,过电位意味着需要高于热力学预期的 中 H 3 O 是主要反应物,这一步发生在接近平衡电位
能量来驱动反应。因此,pH 除了影响析氢反应速率, 的低阴极过电位下,此时电化学反应速度较慢,因
+
还会影响氢吸附速率。水分解的 HER 和 OER 及其 此,中性电解液中较低浓度的 H 可以维持反应。随