Page 152 - 《精细化工》2022年第11期
P. 152
·2302· 精细化工 FINE CHEMICALS 第 39 卷
BLP-2;BLP-1 和 BLP-2 对 MX-1 细胞的增殖具有
明显抑制作用。XU 等 [23] 发现,真菌灵芝多糖对细
胞的增殖和迁移具有时间-剂量依赖性的抑制作用,
在质量浓度为 500 mg/L 时,最大抑制率达到 50.2%,
与 BLP-1 变化趋势基本一致。大多数具有抗癌活性
的多糖含有 4~6 种不同的单糖,其中大多数含有不
同摩尔分数的甘露糖、木糖、岩藻糖、鼠李糖和核
糖 [24-25] ,一些还含有糖醛酸、蛋白质等,这与 BLP-1
和 BLP-2 的化学组成基本一致。研究表明,各种多
糖的共同抗癌机制是细胞周期阻滞、线粒体膜去极
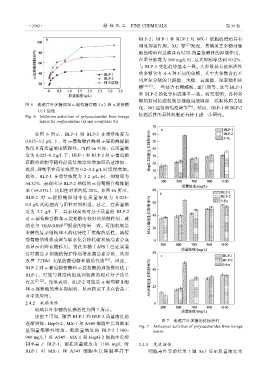
图 6 琉璃苣叶多糖抑制 α-葡萄糖苷酶(a)和 α-淀粉酶
化、NO 途径和免疫调节 [26] 。然而,BLP-1 和 BLP-2
(b)活性
Fig. 6 Inhibition activitives of polysaccharides from borage 抗癌活性的具体机制还有待于进一步研究。
leaves for α-glucosidase (a) and α-amylase (b)
如图 6 所示,BLP-1 和 BLP-2 在质量浓度为
0.025~3.2 g/L 下,对 α-葡萄糖苷酶和 α-淀粉酶抑制
作用具有质量浓度依赖性。由图 6a 可知,在质量浓
度为 0.025~0.2 g/L 下,BLP-1 和 BLP-2 对 α-葡萄糖
苷酶的抑制率随样品质量浓度的增加而迅速增加,
此后,抑制率在质量浓度为 0.2~3.2 g/L 时缓慢增加。
此外,BLP-1 在质量浓度为 3.2 g/L 时,抑制率为
64.32%,表现出与 BLP-2 相似的 α-葡萄糖苷酶抑制
率(68.53%),比阳性对照约低 28%。如图 6b 所示,
BLP-2 对 α-淀粉酶抑制率在质量浓度为 0.025~
0.5 g/L 的范围内与阳性对照相当。总之,在质量浓
度为 3.2 g/L 下,具有较高相对分子质量的 BLP-2
对 α-葡萄糖苷酶和 α-淀粉酶有较好的抑制作用,此
结论与 GIAVASIS [19] 报道的结果一致。可能机制是
多糖的复杂结构和不消化特性干扰酶的活性,减缓
葡萄糖的吸收或调节碳水化合物代谢和胰岛素合成
而显示出降血糖作用。黄芪多糖(APS)已证实通
过对胰岛 β 细胞的保护作用增加胰岛素分泌,从而
改善 T2DM 大鼠的葡萄糖和脂质代谢 [20] 。因此,
BLP-2 对 α-葡萄糖苷酶和 α-淀粉酶的抑制作用优于
BLP-1,可能与其结构组成和较高的相对分子质量
有关 [21-22] 。结果表明,BLP-2 可能是 α-葡萄糖苷酶
和 α-淀粉酶的潜在抑制剂,从而拓宽了其在食品工
业中的应用。
2.4.2 抗癌活性
琉璃苣叶多糖的抗癌活性如图 7 所示。
由图 7 可知,随着 BLP-1 和 BLP-2 质量浓度的
图 7 琉璃苣叶多糖的抗癌活性
逐渐增加, HepG-2、MX-1 和 A549 细胞生长抑制率
Fig. 7 Anticancer activities of polysaccharides from borage
呈剂量依赖性增加。低质量浓度的 BLP-2(300~ leaves
900 mg/L)对 A549、MX-1 和 HepG-2 细胞生长抑
制率高于 BLP-1,而在质量浓度为 1100 mg/L 时 2.4.3 免疫活性
BLP-1 对 MX-1 和 A549 细胞生长抑制率高于 细胞毒性实验结果(图 8a)显示质量浓度为